脂質は横から入って受容体を活性化する
志甫谷 渉(生物科学専攻 助教)
濡木 理(生物科学専攻 教授)
脂質は細胞膜の主な構成要素であり, 自己と非自己の境界を形作っている。
一方で, 特定の脂質は膜にある受容体を活性化することでシグナル伝達分子として機能する。
こうした脂質分子は脂質メディエーターと呼ばれ, そのシステムの破綻はさまざまな病気につながる。
私たちは, 脂質メディエーターの一種であるリゾフォスファチチルセリンを結合した受容体が,
細胞にシグナルを伝えている状態の立体構造を決定した。
その結果, 脂質が受容体の横側から入って受容体を活性化するメカニズムが明らかになった。
![]()
リゾホスファチジルセリン(LysoPS)注1)は細胞間の情報伝達を担う脂質メディエーターの一種であり, 生体内ではホスファチジルセリンのアシル基の一本が切断されることで産生される。LysoPSは一本のアシル基とリン脂質頭部にセリンを持つ脂質である。LysoPSはGPR34と呼ばれる受容体を活性化することで免疫系のはたらきを調節するため, とくにがんや感染症への対策として研究が進められている。しかし, 真にGPR34のリガンドであるのかについては反論があり, LysoPSが分子レベルでどのようにGPR34を活性化するのかについては不明だった。
そこで私たちはLysoPSがなぜGPR34を活性化できるのか解明すべく, その立体構造を研究した。私たちは受容体タンパク質を大量に作り,LysoPSが結合した状態で高純度に精製した。さらに,三量体Gタンパク質注2)を混合することで, Gタンパク質を活性化している状態のシグナル伝達複合体を得た(図,左)。複合体を薄い氷に閉じ込めたグリッドを作製し, 低温電子顕微鏡によって撮影した。撮影した画像から10万粒子の画像を抽出し, 単粒子解析と呼ばれる手法によって複合体の構造決定に成功した。
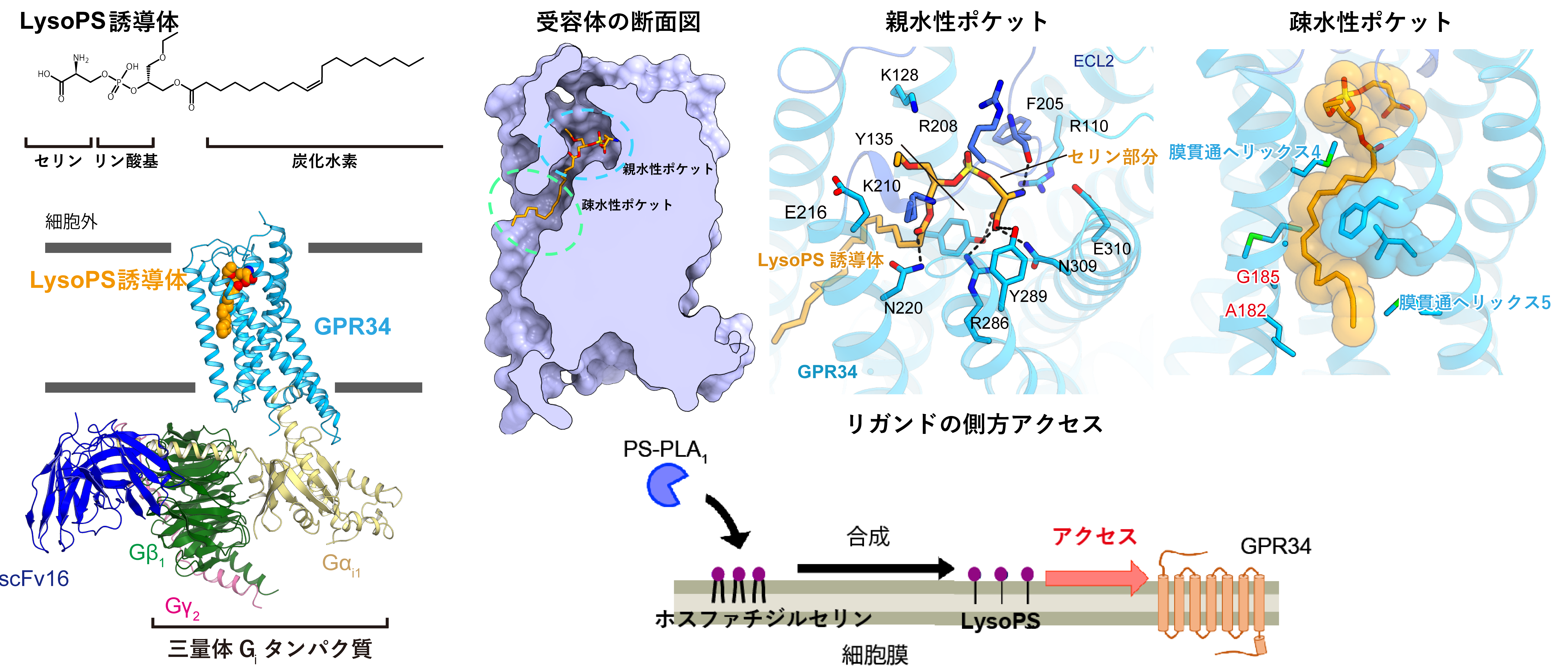 GPR34のシグナル伝達複合体の全体構造。左:LysoPSの分子構造およびシグナル伝達複合体の全体構造。右上:受容体のポケットの断面図および親水性,疎水性ポケットでの相互作用。右下:PS-PLA1による受容体活性化モデル。作られた脂質は膜上を移動して横から受容体に入る
GPR34のシグナル伝達複合体の全体構造。左:LysoPSの分子構造およびシグナル伝達複合体の全体構造。右上:受容体のポケットの断面図および親水性,疎水性ポケットでの相互作用。右下:PS-PLA1による受容体活性化モデル。作られた脂質は膜上を移動して横から受容体に入る
GPR34のリガンド結合ポケットは, リガンドの頭部を認識する親水性ポケットと, 炭化水素基を収容する疎水性ポケットから構成されていた(図,右上)。親水性ポケットでは, LysoPSのセリン部分は極性アミノ酸残基との水素結合を形成して密に認識されていた。このセリン特異的な相互作用が, GPR34がさまざまな脂質の中でLysoPSのみを受容しシグナルを伝える理由であると考えられる。一方炭化水素基は, 4番目と5番目の膜貫通ヘリックス注3)によって形成された溝にある疎水性ポケットに収容されていた。GPR34のリガンド結合ポケットは,この溝を介して細胞膜側(横向き)に開いていた。LysoPSは細胞間接着を介して膜上を移動すると考えられおり,実際に, LysoPS産生酵素(PS-PLA1)を作用することで, GPR34は外からLysoPSを加えなくても活性化する。このことから, 細胞外側からの経路ではなく、細胞膜側からのLysoPSのアクセスがGPR34の機能に重要であることがわかり(図,右下), 受容体研究に大きな一石を投じる成果となった。
本研究成果は,T.Izume, et al. Nat. Commun. 81, 3205(2024)に掲載された。
注1)LysoPS:本研究では,構造解析のためにLysoPSの誘導体を使った。
注2)三量体G タンパク質:細胞のシグナル伝達において重要な役割を果たすヘテロ三量体のタンパク質。受容体と結合すると三量体がかい離し,下流のタンパク質と相互作用してシグナルを伝える。
注3)膜貫通ヘリックス:タンパク質の一部が細胞膜を通過するときに,α-ヘリックスと呼ばれる螺旋状の構造を形成する。


