DATE2024.02.07 #Press Releases
免疫応答に関わるLysoPS受容体の活性型構造の解明
――作動薬の結合様式を解明し、創薬研究に貢献――
井爪 珠希(研究当時:生物科学専攻 博士課程)
川原 凌(生物科学専攻 修士課程)
志甫谷 渉(生物科学専攻 助教)
濡木 理(生物科学専攻 教授)
上水 明治(研究当時:東京大学大学院薬学系研究科 特任研究員)
陳 露瑩(東京大学大学院薬学系研究科 特任研究員)
大和田 智彦(東京大学大学院薬学系研究科 教授)
青木 淳賢(東京大学大学院薬学系研究科 教授)
発表のポイント
- 2種類の合成作動薬がそれぞれ結合したGPR34と三量体Gタンパク質Giとの複合体の構造決定に成功しました。
- 作動薬の結合様式を明らかにし、構造情報に基づいたMDシミュレーションによって天然LysoPSとの結合モードの差異や類似点を解明しました。また、細胞膜上で産生されたリガンド (LysoPS) が受容体側面から受容体内部のポケットにアクセスすることを示しました。
- 本研究の成果は、GPR34を治療標的とした新規の薬剤設計を加速します。
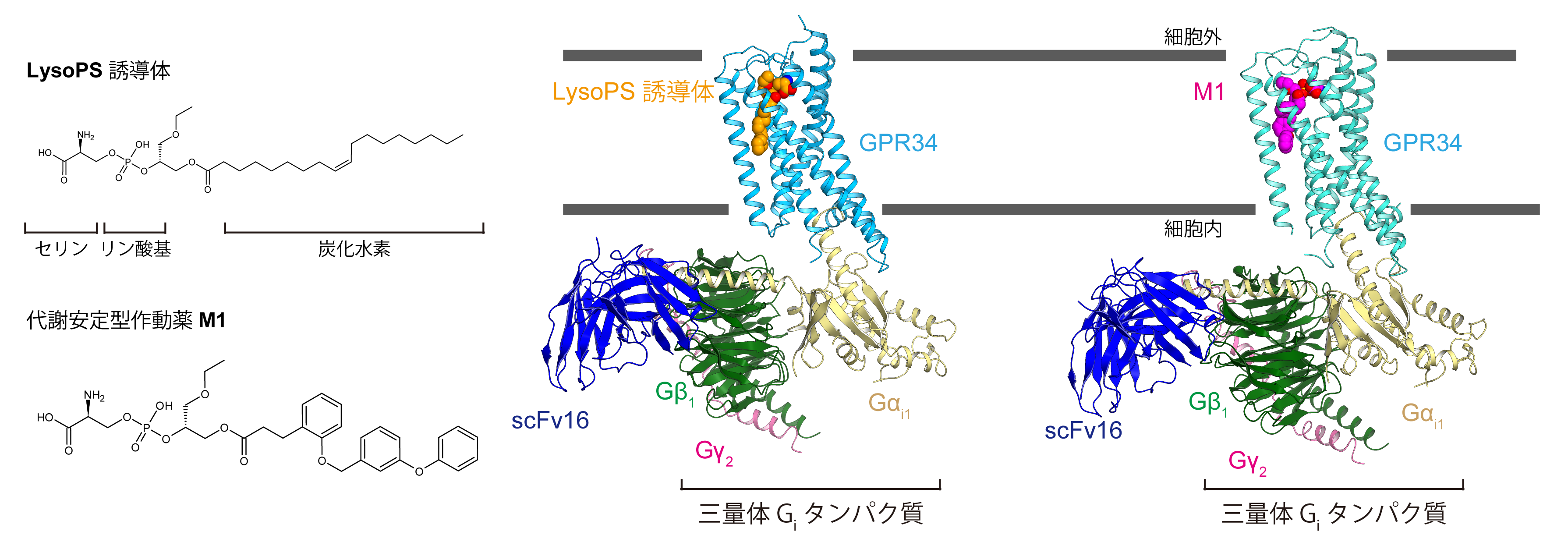
GPR34作動薬とGPR34-Gi複合体
発表概要
今回、東京大学大学院理学系研究科の濡木理教授らのグループは、同大学大学院薬学系研究科の大和田智彦教授、青木淳賢教授との共同研究のもと、リゾホスファチジルセリン(注1) (LysoPS) 非天然型誘導体および脂質部分を芳香族に置き換えた代謝安定型作動薬によって活性化した、GPR34と三量体Gタンパク質Gi (注2)とのシグナル伝達複合体の立体構造をクライオ電子顕微鏡(注3)による単粒子解析によって決定しました。
LysoPSは細胞間の情報伝達を担います。LysoPS受容体の一つと報告されてきたGPR34は免疫細胞を含む広範な細胞で発現し、組織の修復や感染症の抑制などの機能に関与します。しかしGPR34がどのようなLysoPS分子種により活性化されるのか、LysoPSがどのように産生されGPR34に受け渡され、活性化するかは不明でした。決定した2種類の構造から、細胞膜に開いたリガンド(注4)結合ポケットや、天然型のLysoPSを含む作動薬の特徴的な結合様式を明らかにしました。また、細胞膜上で産生されたLysoPSが直接GPR34の側面から受容体内部のポケットにアクセスすることが示されました。本研究の成果から、より効果的な作動薬の設計が可能となり、創薬研究への貢献が期待されます。
発表内容
LysoPSは一本のアシル基とリン脂質頭部にセリンを持ちます。LysoPSを受容するGタンパク質共役型受容体 (GPCR) (注5)は、青木教授によってGPR34、GPR174、P2Y10の3種類が同定されています。GPR34は複数の免疫亢進シグナルに関与すると報告されてきましたが、LysoPSが真にGPR34のリガンドであるのかについては議論があり、またLysoPSが分子レベルでどのようにGPR34を活性化するのかについては不明でした。LysoPSとGPR34の結合様式を明らかにすることでLysoPSが真にGPR34のリガンドであるかについて結論を出すことができると考えられてきました。また、大和田教授によってより親和性や選択性を強めたGPR34作動薬が開発されています。特に、セリン・リン酸部位と脂肪酸の結合位置を天然型とは変更し、脂質の炭化水素部分を芳香族に置き換えることで強力な作動活性を示す代謝安定型作動薬M1はGPR34とリガンドの結合様式を明らかにする上で有用です。
本研究グループは、クライオ電子顕微鏡による単粒子解析法を用いて、セリン・リン酸部位と脂肪酸の結合位置を天然型とは変更したLysoPS誘導体および代謝安定型作動薬M1が結合した、GPR34および三量体Gタンパク質Giで構成されるシグナル伝達複合体の立体構造を解明しました。
GPR34のリガンド結合ポケットは、リガンドの極性頭部を認識する親水性ポケットと、炭化水素基を収容する疎水性ポケットから構成されていました。LysoPSのセリン部分は極性残基との水素結合を形成していました。このセリン特異的な相互作用が、GPR34がさまざまなリゾリン脂質の中で、確かにLysoPSのみを受容しシグナルを伝える理由であると考えられます。一方炭化水素基は、膜貫通ヘリックス4と5の間にある溝にある疎水性ポケットに対してL字型をとって収容されていました (図1)。
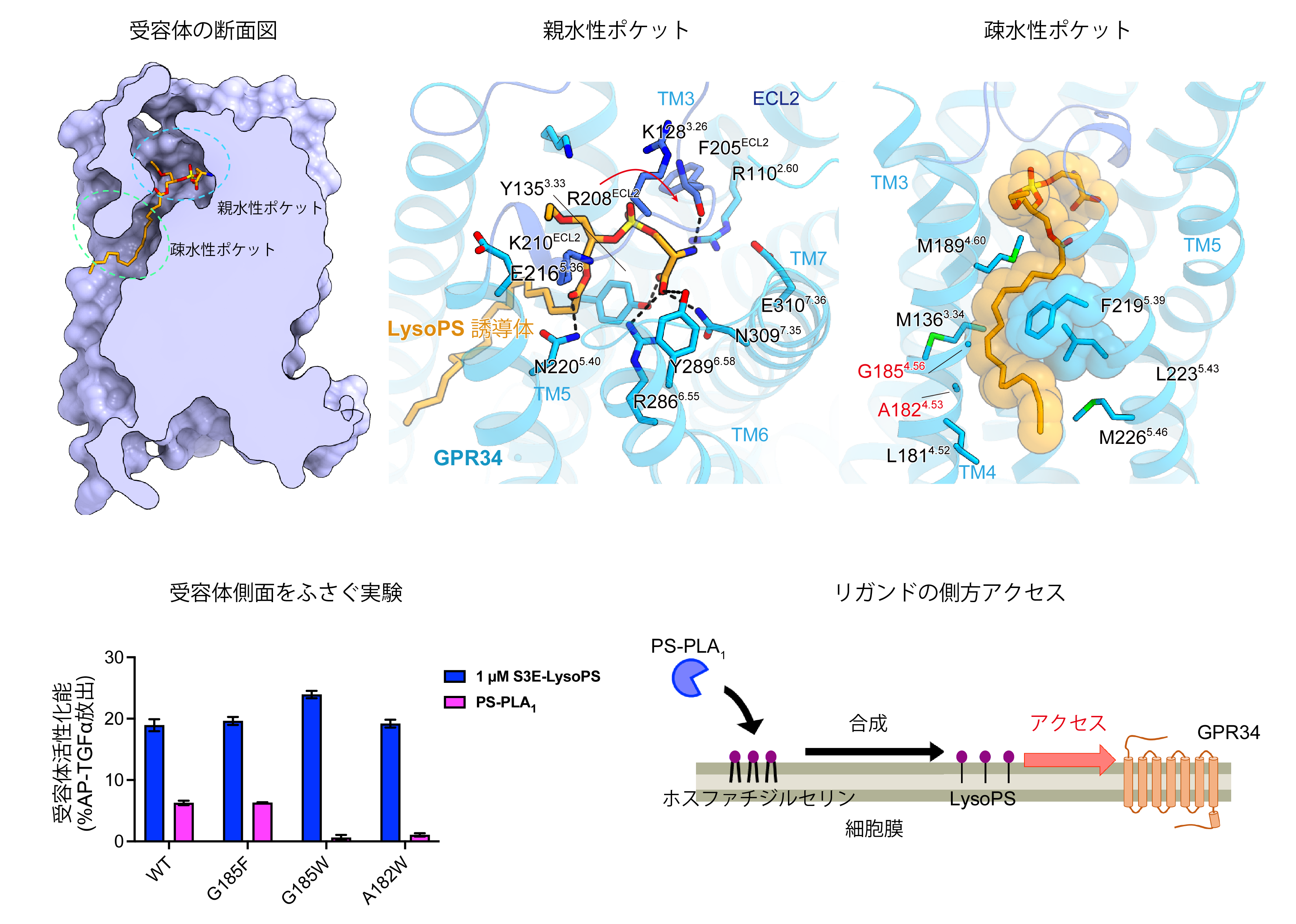
図1:LysoPS誘導体の結合様式とGPR34に対するリガンドの側方アクセス
GPR34のリガンド結合ポケットは、細胞外側に対してのみならず、膜貫通ヘリックス4と5の間の溝を介して、細胞膜側に対して開いていました。LysoPS産生酵素PS-PLA1や、溝をかさ高い残基によって塞いだ変異体を用いた実験により、細胞膜側からのLysoPSのアクセスが機能に重要であることがわかりました 。
代謝安定型作動薬M1は、LysoPS誘導体と同様な位置に結合していました。特に、M1の芳香環部分はLysoPS誘導体のように、膜貫通ヘリックス4と5の間の溝の間にL型ではまり込み疎水性残基と相互作用してより安定に結合していました (図2)。膜貫通ヘリックス4はLysoPS誘導体結合型構造と比較して2.33 Å外側に動いており、かさ高い芳香族部分を収容することが出来るように変化していました。これらの結合ポーズはMDシミュレーションから得られたsn-2型のLysoPSの結合ポーズに似ているものの、sn-1型のLysoPSの結合ポーズは異なっていました。このことから天然型LysoPSのsn-1型はGPR34活性化が弱く、sn-2型が活性化の本体である可能性を支持するものです。
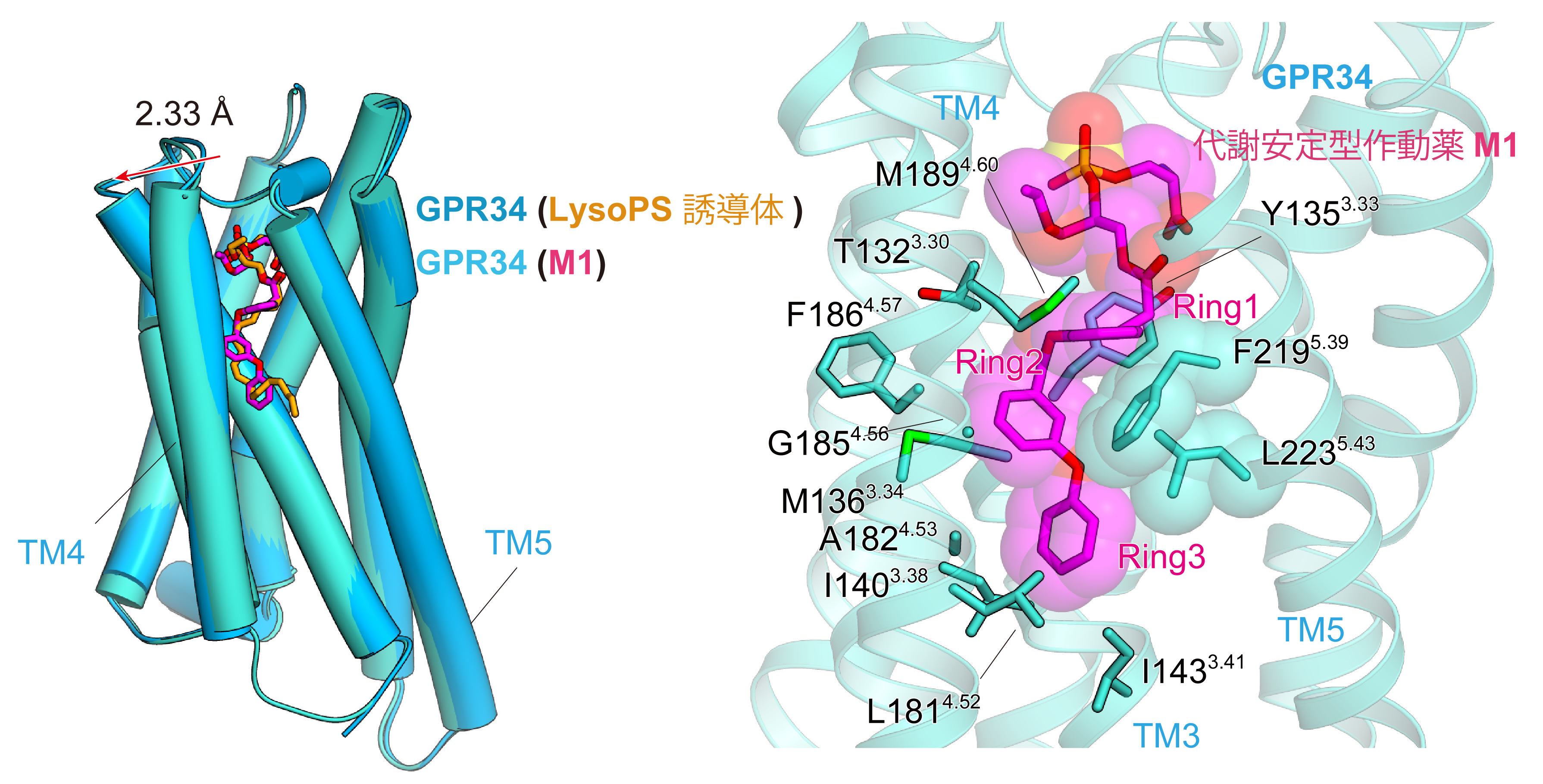
図2:代謝安定型作動薬M1の結合様式
また本論文の投稿中に公開されたLysoPS受容体GPR174との比較により、GPR34との共通点と相違点が明らかになりました。GPR174はGPR34と同様にリガンドのセリン部分を密に認識していましたが、GPR34に特徴的なL字型の疎水性ポケットはGPR174には見られませんでした (図3)。代謝安定型作動薬M1はL型の疎水性ポケットにちょうどはまるように相互作用していることからも、こうした疎水性ポケットの形の違いは、作動薬の選択性に重要であり、今後各々のLysoPS受容体選択的な薬剤を設計するのに重要な情報だと考えられます。

図3:LysoPS受容体GPR34とGPR174の構造比較
〇関連情報:
「がんや肺炎にかかわるLPA受容体の活性型構造の解明 ―新規化合物との相互作用を明らかにし、創薬研究に貢献―」(2022/9/20)
論文情報
-
雑誌名 Nature Communications 論文タイトル Structural basis for lysophosphatidylserine recognition by GPR34著者 Tamaki Izume, Ryo Kawahara, Akiharu Uwamizu, Luying Chen, Shun Yaginuma, Jumpei Omi, Hiroki Kawana, Fengjue Hou, Fumiya K. Sano, Tatsuki Tanaka, Kazuhiro Kobayashi, Hiroyuki H. Okamoto, Yoshiaki Kise, Tomohiko Ohwada, Junken Aoki, Wataru Shihoya*, Osamu Nureki*DOI番号
研究助成
本研究は、日本学術振興会における科学研究費助成事業の基盤S「生体環境でのGPCRの構造ダイナミクス」(課題番号:21H05037 研究開発代表者:濡木 理)や基盤B「クライオ電子顕微鏡法を用いたGPCR創薬研究」(課題番号:22H02751 研究開発代表者:志甫谷 渉)、基盤A「リゾリン脂質メディエーターの新規免疫制御機構の解明とその薬学的意義」(課題番号:22H00438 研究開発代表者:青木 淳賢)、基盤B「生体分子の構造動的選択手法の確立と応用」(課題番号:23H02600 研究開発代表者:大和田 智彦)やAMED革新的がん医療実用化研究事業「がん免疫におけるリゾリン脂質シグナルの意義解明とリゾリン脂質受容体を標的とした抗がん剤開発」(課題番号:22ck0106533h0003 研究開発代表者:青木 淳賢)の一環で行われました。また、本研究は、AMED「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
用語解説
注1 リゾホスファチジルセリン、LysoPS
リゾホスファチジルセリン (LysoPS) は細胞間の情報伝達を担う脂質メディエーターの一種であり、生体内ではホスファチジルセリンのアシル基の一本が切断されることで産生される。LysoPSを特異的に認識する受容体はGPR34、P2Y10、GPR174の3種類とされており、これらはいずれもGタンパク質共役受容体である。グリセロール骨格に、ホスホセリン基と脂肪酸が結合した構造をもつ。脂肪酸の付く位置によってsn-1型とsn-2型がある。天然ではsn-1型が多く存在しているが、sn-1型の活性は弱く、sn-2型の活性が強いことが示唆されていた。↑
注2 Gタンパク質、三量体Gタンパク質Gi
Gタンパク質は、細胞内情報伝達に関わるGTP結合タンパク質であり、Gα、Gβ、Gγサブユニットの三量体により構成されている。活性化されたGタンパク質共役受容体と結合したGタンパク質三量体では、GDP-GTP交換反応が起き、GαとGβ-Gγの二つに解離する。解離したサブユニットが下流のシグナル伝達因子と結合し活性化することで、細胞にさまざまなシグナル応答が生じる。Gαサブユニットは大きくGs、Gi、Gq/11、G12/13の4種類に分別され、特にGiは、下流でアデニル酸シクラーゼの活性を阻害することで、抑制性のシグナルを伝達する。↑
注3 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸をはじめとする生体高分子の像を多数撮影することで立体構造の決定を行う、単粒子解析法に用いられる。↑
注4 リガンド
受容体に対して結合し機能を発揮するホルモンなどの化学物質をリガンドと呼ぶ。ここでは内在性の作動薬のことを指す。↑
注5 Gタンパク質共役受容体、GPCR
GPCRは細胞膜に発現する膜タンパク質で、膜を貫通する7本のαヘリックスで構成されている。膜受容体タンパク質のなかで最大のファミリーを形成し、細胞外領域で特定のリガンドが結合することで活性化し、細胞内の三量体Gタンパク質を活性化することでシグナルを伝達する。体内で多様な生理作用の調節に重要な役割を果たすことから、既承認薬の30%以上がGPCRを標的にした薬剤になっている。↑


