DATE2025.04.23 #Press Releases
飢餓時の代謝トランスオミクスネットワークの構造的堅牢性と時間的脆弱性
——飢餓適応システムとしての生物学的鳥瞰図を描く——
発表のポイント
- 詳細な時系列データと大規模解析、それを統合し俯瞰するネットワーク解析を駆使して、マウスの肝臓における飢餓適応の全容を解明し、肥満が引き起こす病理像を明らかにしました。
- その結果、飢餓時のマウス肝臓の細胞内分子ネットワークが、肥満に対して構造的には堅牢である一方、時間的には脆弱であることを示しました。
- 本研究の成果は、生活習慣病の治療介入への貢献や、医学・生命科学ビッグデータを理解する方法論としての応用が期待されます。

マウス肝臓における飢餓時の代謝トランスオミクスネットワーク
発表概要
東京大学大学院理学系研究科生物科学専攻の黒田真也教授と、同研究科附属遺伝子実験施設の守田啓悟助教らによる研究グループは、新潟大学大学院医歯学総合研究科の松本雅記教授、幡野敦助教、奈良先端科学技術大学院大学の小鍛治俊也助教、東京大学大学院新領域創成科学研究科の鈴木穣教授、九州大学生体防御医学研究所の馬場健史教授、和泉自泰准教授、高橋政友助教、慶應義塾大学先端生命科学研究所の曽我朋義教授、平山明由准教授らとの共同研究により、マウス肝臓における飢餓時の代謝トランスオミクスネットワーク(注1)が、肥満に対して構造的には堅牢(けんろう)である一方、時間的には脆弱であることを明らかにしました。
本研究では、大規模な時系列データから構築した飢餓時の代謝トランスオミクスネットワークを、ネットワーク理論(注2)と時定数(注3)から読み解きました。その結果、これまで個別の分子ごとに研究されていた飢餓への適応が、システムとしてどのように統合されているのかを統一的に明らかにすることに成功しました。また、そのようなシステムが肥満によってどのような障害を引き起こすのかについても突き止めました。本研究の研究成果は、肥満や糖尿病などの病理の理解や、それらの治療法の開発に役立つことが期待されます。
発表内容
飢餓時には、数多くの分子を時間的に秩序立てて動員し、次の食事まで代謝の恒常性を維持する必要があります。しかし、このような緻密な制御を可能にするシステムの設計原理や、肥満による病理的変化については十分に分かっていませんでした。それは、飢餓時の大規模計測を詳細な時系列で実施する研究が不足していたためでした。
そこで、本研究では、代謝の中心を担う臓器である肝臓に着目し、正常マウスと肥満モデルマウス(ob/obマウス:食欲抑制ホルモンであるレプチンを欠損したマウス)の飢餓時の肝臓における水溶性代謝物(注4)、脂質(注5)、遊離脂肪酸・アシルカルニチン・アシルCoA(注6)、転写物(注7)、タンパク質(注8)、タンパク質リン酸化(注9)を網羅的に計測しました。計測した分子の中から、健常マウス・肥満モデルマウスそれぞれにおいて有意に変動した分子を抽出しました。データベースを用いて抽出した分子が制御する代謝反応を同定し、それらをつなぎ合わせることで、マウス肝臓における飢餓時の代謝トランスオミクスネットワークを構築しました(図1)。
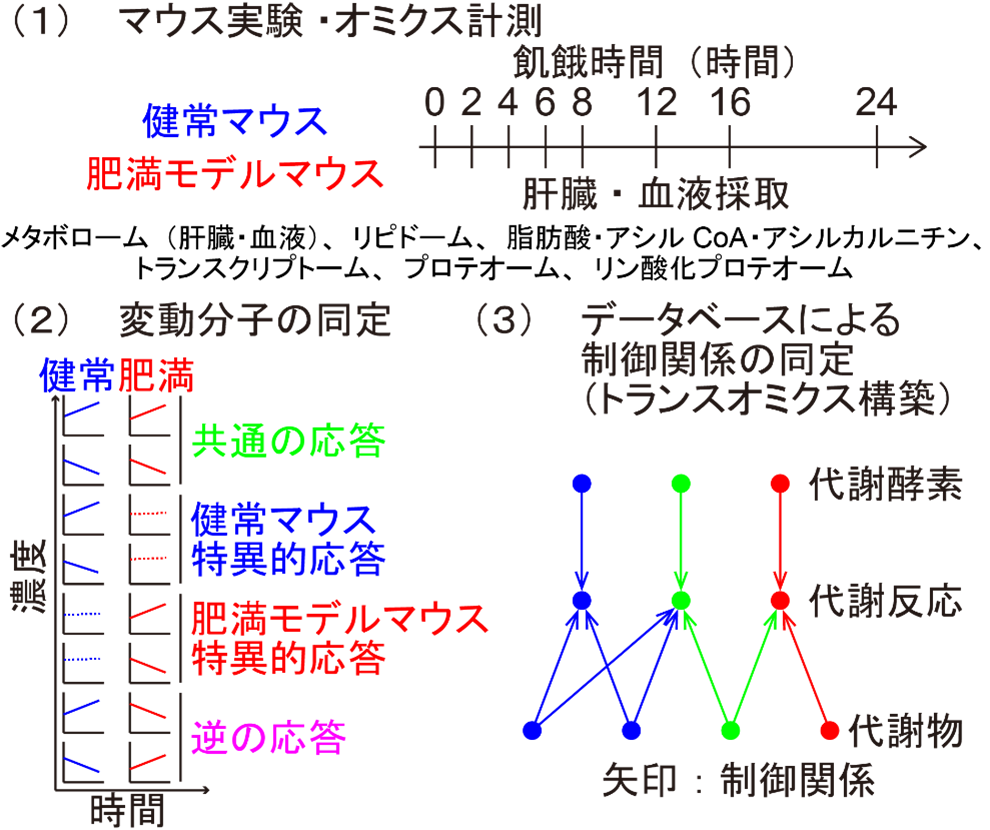
図1:飢餓時の代謝トランスオミクスネットワークの構築
(1)健常マウスと肥満モデルマウスの飢餓開始後計8時点の肝臓と血液を回収し、各種オミクス計測を行いました。(2)各分子が、健常マウスと肥満モデルマウスで有意に応答したかどうかを判定し、共通に応答した分子、健常マウス特異的に応答した分子、肥満モデルマウス特異的に応答した分子、逆の応答を示した分子の4つに分類しました。(3)飢餓に対して変化を示した分子が制御する代謝反応をデータベースによって同定し、それらの制御関係を結び、飢餓時の代謝トランスオミクスネットワークを構築しました。
このようにして構築したトランスオミクスネットワークは非常に膨大な情報を含むため、解釈に困難を来すことがしばしばありました。そこで、本研究においてはネットワーク理論と時定数を用いた解析によって、飢餓時のマウス肝臓における代謝トランスオミクスネットワークを読み解きました(図2)。その結果、健常マウスの肝臓においては、ATPやAMP(注10)といったエネルギー関連代謝物を中心としたスケール・フリー様ネットワーク(注11)が構築されていました。肥満モデルマウスにおいては、ATPやAMPが脂質などに置き換わっていたものの、スケール・フリー様ネットワークの構造が維持されていました。このことは、飢餓時でもマウス肝臓における代謝トランスオミクスネットワークの構造が肥満で保持されている、すなわちネットワークの構造が肥満に対して堅牢であることを示唆しています。一方、時定数を用いて解析すると、正常肝臓ではATPやAMPといったネットワークの中心にある分子がより迅速に応答し、グリコーゲン分解(注12)、糖新生(注13)、脂肪酸分解(注14)が秩序だって応答していたのに対し、肥満モデルマウスではそのような秩序が失われていました。このことは、飢餓時代謝トランスオミクスネットワークでは肥満で時間的な秩序が失われる、すなわち時間的には肥満に対して脆弱であることを示唆しています。
本研究の成果は、飢餓適応をシステムとして理解することで、代謝恒常性を生物がどのようにして維持しているのかを明らかにすることに成功しました。このことは、肥満や糖尿病などの病理の理解や、それらの治療法の開発に役立つことが期待されます。

図2:飢餓時のマウス肝臓における代謝トランスオミクスネットワークは、構造的には堅牢である一方時間的には脆弱である
飢餓時のマウス肝臓における代謝トランスオミクスネットワークを、ネットワーク理論と時定数によって読み解いた。健常マウスではATP、AMPを中心とした、肥満モデルマウスでは脂質などを中心としたネットワークが構築されており、肥満に対して構造的には堅牢だった。一方、健常マウスでみられた時間的秩序は肥満マウスで消失しており、飢餓時のマウス肝臓における代謝トランスオミクスネットワークが、時間的には肥満に対して脆弱であることが示された。
〇関連情報:
「プレスリリース①トランスオミクスネットワークを構築・解析するwebアプリ「iTraNet」の開発」(2024/10/22)
https://www.s.u-tokyo.ac.jp/ja/press/10522/
「プレスリリース②肥満による摂食時の代謝異常をマウス肝臓のトランスオミクスネットワーク解析により解明」(2024/02/27)
https://www.s.u-tokyo.ac.jp/ja/press/10119/
論文情報
-
雑誌名 Science Signaling 論文タイトル Structural robustness and temporal vulnerability of the starvation-responsive metabolic network in healthy and obese mouse liver著者 Keigo Morita, Atsushi Hatano, Toshiya Kokaji, Hikaru Sugimoto, Takaho Tsuchiya, Haruka Ozaki, Riku Egami, Dongzi Li, Akira Terakawa, Satoshi Ohno, Hiroshi Inoue, Yuka Inaba, Yutaka Suzuki, Masaki Matsumoto, Masatomo Takahashi, Yoshihiro Izumi, Takeshi Bamba, Akiyoshi Hirayama, Tomoyoshi Soga, and Shinya Kuroda* DOI番号 10.1126/scisignal.ads2547
研究助成
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 CREST 研究領域「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出」研究課題名「時空間トランスオミクスを用いた多細胞・臓器連関代謝制御の解明」(課題番号:JPMJCR2123 研究代表者:黒田真也)、同 先端国際共同研究推進事業(ASPIRE)研究課題名「細胞運命決定のデータ駆動型マルチスケールエンジニアリング」(課題番号 JPMJAP24B1 共同研究者:黒田真也)、日本学術振興会における科学研究費助成事業の新学術領域研究(研究領域提案型)「2型糖尿病の代謝アダプテーション」(課題番号:JP17H06299、JP17H06300 研究代表者:黒田真也)、学術変革領域研究(A)冬眠生物学2.0(課題番号:JP23H04939、JP23H04946 研究代表者:黒田真也)、若手研究 飢餓時代謝アダプテーションのトランスオミクス解析(課題番号:21K15342、研究代表者:守田啓悟)の一環として行われました。
用語解説
注1 代謝トランスオミクスネットワーク
代謝反応とそれを制御する代謝物・代謝酵素・シグナル経路・遺伝子発現・代謝物層にまたがる大規模ネットワークのこと。↑
注2 ネットワーク理論
インターネットや神経回路、細胞内の分子間ネットワークなど、個々の要素とそれらの間の関係性によって成り立つネットワークの性質を研究する理論。↑
注3 時定数
ある分子の時系列データに対し、刺激前のデータから最も大きな応答幅の半分の応答に達するまでの時間。応答の速さの指標として用いることができ、応答が速いほど時定数は小さくなり、応答が遅いほど時定数は大きくなる。↑
注4 水溶性代謝物
生体が代謝する物質のうち、水に溶けやすい性質をもつもの。糖質やアミノ酸などが知られている。↑
注5 脂質
生体が代謝する物質のうち、水に溶けにくい性質をもつもの。↑
注6 遊離脂肪酸・アシルカルニチン・アシルCoA
脂質のうち、一鎖の炭化水素基とカルボキシル基からなる分子を遊離脂肪酸と呼ぶ。遊離脂肪酸を構成する炭化水素基は伸長したり分解されたりする。その際に生じる中間体をアシルカルニチン、アシルCoAと呼ぶ。↑
注7 転写物
アデニン・グアニン・シトシン・ウラシルからなる核酸(RNA)。遺伝情報をタンパク質に変換する際の中間体としての役割を果たす。↑
注8 タンパク質
20種類のアミノ酸からなる高分子。さまざまな立体構造をとり、生体内で多彩な機能を担う。↑
注9 タンパク質リン酸化
タンパク質の特定のアミノ酸にリン酸基と呼ばれる官能基が付加されること。酵素の活性など、タンパク質の機能に影響を及ぼす場合も数多く知られている。↑
注10 ATPやAMP
ATPは細胞内のさまざまな現象に必要なエネルギーを供給する分子である。ATPがエネルギーを失うとAMPとなる。↑
注11 スケール・フリー様ネットワーク
少数のハブ(他の構成要素と数多く相互作用する構成要素)と多数の葉(他の構成要素とあまり相互作用しない構成要素)からなるネットワークを、スケール・フリーネットワークと呼び、数学的にさまざまな性質が知られている。本研究の代謝トランスオミクスネットワークは厳密な定義を満たさないため、スケール・フリー様ネットワークと呼んでいる。↑
注12 グリコーゲン分解
グルコースが数珠状につながった高分子であるグリコーゲンを分解する代謝反応。↑
注13 糖新生
アミノ酸などの代謝物からグルコースを合成する代謝反応。↑
注14 脂肪酸分解
脂肪酸を分解する代謝反応。↑


