DATE2024.02.27 #Press Releases
肥満による摂食時の代謝異常をマウス肝臓のトランスオミクスネットワーク解析により解明
――肥満に伴う代謝異常は食餌状態(摂食・絶食)によって異なる――
黒田 真也 (生物科学専攻 教授)
白 云帆 (生物科学専攻 特任研究員)
守田 啓悟 (附属遺伝子実験施設 助教)
発表のポイント
- 摂食時の肝臓において、野生型マウスと肥満モデルマウスの差分トランスオミクスネットワークを構築し、肥満に伴う代謝異常の全容を明らかにしました。
- 肥満モデルマウスを使った絶食時の代謝異常の研究は数多くありましたが、摂食時のトランスオミクスネットワーク解析は本研究によって初めて行われました。その結果、絶食時とは異なる点を数多く見いだしました。
- 摂食時のトランスオミクスネットワークを絶食時のトランスオミクスネットワークと比較することによって、肥満における代謝異常のメカニズム解明や代謝疾患の予防や治療に役立つと考えられます。

摂食時マウス肝臓における差分トランスオミクスネットワーク解析
発表概要
東京大学大学院理学系研究科生物科学専攻の白云帆特任研究員、黒田真也教授、附属遺伝子実験施設の守田啓悟助教らによる研究グループは、奈良先端科学技術大学院大学の小鍛治俊也助教、新潟大学大学院医歯学総合研究科の松本雅記教授、幡野敦助教、東京医科歯科大学M&Dデータサイエンスセンターの大野聡講師、理化学研究所生命医科学研究センターの柚木克之チームリーダー、金沢大学新学術創成研究機構の井上啓教授、稲葉有香准教授、東京大学大学院新領域創成科学研究科の鈴木穣教授、九州大学生体防御医学研究所の馬場健史教授、和泉自泰准教授、高橋政友助教、慶應義塾大学先端生命科学研究所の曽我朋義教授、平山明由准教授らと共同研究を行い、摂食時の肝臓における差分トランスオミクスネットワーク(注1)を構築し、肥満に伴う代謝異常の全容を明らかにしました。
本研究では、摂食時の野生型マウスと肥満モデルマウスの肝臓における差分トランスネットワークを新たに構築し、既に報告されていた絶食時の差分トランスオミクスネットワークと比較することにより、摂食時と絶食時で異なる病態を有することを解明しました(図1)。通常のライフスタイルにおいては、絶食時よりも摂食時の方が生理的状態に近いため、本研究成果は肥満における代謝異常のメカニズム解明や、将来的に肥満に伴う代謝疾患の予防や治療に役立つと考えられます。
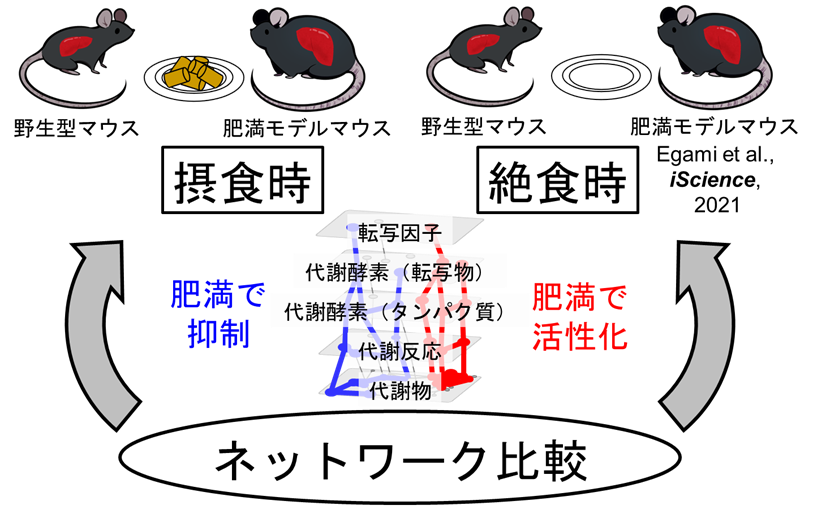
図1:肥満における代謝異常ネットワークの摂食時と絶食時における比較
網羅的計測から構築した肥満における摂食時の代謝異常ネットワークを構築し、既に報告されていた絶食時のネットワークと比較した。
発表内容
肝臓は、摂食や絶食に応じてさまざまな代謝制御ネットワークを動員することによって全身の代謝恒常性を維持しています。摂食時には豊富に供給されるグルコースを利用し、絶食時にはそれまでに蓄積していた脂肪を利用します。肥満は肝臓の代謝異常を引き起こし、2型糖尿病などの生活習慣病の発症に重要な役割を果たしています。非常に多数の要因や分子が関わるため、マルチオミクス計測(注2)による全容解明が必要ですが、多くの研究においては、サンプリングのタイミングと最終摂食のタイムラグによる影響を除去するため、数時間以上の絶食処理を行ってから解析がなされていました。そのため、通常のライフスタイルにおける生理的状態により近い摂食時のトランスオミクスネットワーク解析は行われていませんでした。
本研究では、自由に摂食できる条件下において、野生型マウスと肥満モデルマウス(ob/obマウス:食欲抑制ホルモンであるレプチンを欠損したマウス)の肝臓を採取し、マルチオミクス計測を行いました。すなわち、メタボローム(水溶性代謝物)(注3)、リピドーム(脂質)(注4)、トランスクリプトーム(遺伝子転写物)(注5)、プロテオーム(タンパク質)(注6)、リン酸化プロテオーム(タンパク質リン酸化)(注7)を計測しました。野生型マウスと肥満モデルマウスを比較して、変動している分子を同定しました。データベースを用いて、これらの分子の制御因子(転写因子・キナーゼ)の活性を推定し、各分子間の制御関係(発現・リン酸化制御、触媒、基質・産物、アロステリック制御)(注8)を同定しました。これら全ての情報を統合し、包括的代謝ネットワーク(差分トランスオミクスネットワーク)を構築しました。このネットワークを解析することで、肥満による病理的変化の同定が可能になります。
このようにして作成した差分トランスオミクスネットワークを、既に報告されていた絶食時における野生型マウスと肥満モデルマウスの差分トランスオミクスネットワークと比較しました(図1)。その結果、肥満モデルマウスでは、摂食条件下においてもグルコースを十分に代謝することができず、脂肪酸代謝に依存している傾向が今回明らかになりました。特に摂食時では血糖値が高いにも関わらず、肝臓での解糖系の中間代謝物が、野生型マウスと比較して減少していました。加えて、摂食時においては肥満によってアデノシン三リン酸(ATP)(注9)をはじめとした多くの代謝物が減少 していました。このような減少を示した代謝物には、代謝酵素を負に制御するアロステリック制御因子 が数多く含まれており、これらの代謝経路が活性化される ことが分かりました。このように新しい差分トランスオミクスネットワークを活用することで、摂食時と絶食時において、アロステリック制御が肥満という病態に対して対照的な寄与を有することが明らかとなりました。 なお、転写因子 (注10)を起点とする遺伝子制御ネットワークにおいては摂食時と絶食時で大きな差はないことから、代謝物による制御が環境の変化(摂食・絶食)によって特に大きく変動することを示唆しています。本研究の成果は、将来的に肥満における代謝異常のメカニズム解明や、肥満に伴う代謝疾患の予防や治療に役立つと考えられます。(図2)
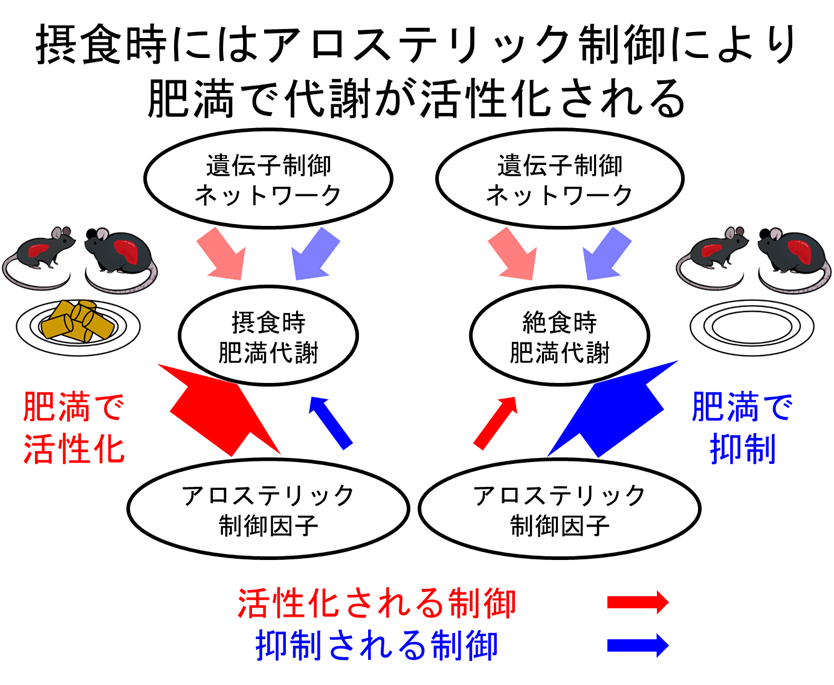
図2:アロステリック制御が駆動する肥満病態の摂食状態における変化
摂食時には肥満の代謝ネットワークがアロステリック制御により活性化される。
〇関連情報:
「肝臓-筋肉の臓器連関代謝サイクルの肥満による制御異常の解明」(2021/3/10)
論文情報
-
雑誌名 iScience 論文タイトル Trans-omic analysis reveals opposite metabolic dysregulation between feeding and fasting in liver associated with obesity著者 Yunfan Bai, Keigo Morita, Toshiya Kokaji, Atsushi Hatano, Satoshi Ohno, Riku Egami, Yifei Pan, Dongzi Li, Katsuyuki Yugi, Saori Uematsu, Hiroshi Inoue, Yuka Inaba, Yutaka Suzuki, Masaki Matsumoto, Masatomo Takahashi, Yoshihiro Izumi, Takeshi Bamba, Akiyoshi Hirayama, Tomoyoshi Soga, and Shinya Kuroda*DOI番号
研究助成
本研究は、科学技術振興機構(JST)における戦略的創造研究推進事業CREST「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出」研究領域 研究課題名「時空間トランスオミクスを用いた多細胞・臓器連関代謝制御の解明」(課題番号:JPMJCR2123 研究代表者:黒田真也)、日本学術振興会における科学研究費助成事業の新学術領域研究(研究領域提案型)「2型糖尿病の代謝アダプテーション」(課題番号:JP17H06299、JP17H06300 研究代表者:黒田真也)の一環として行われました。
用語解説
注1 トランスオミクスネットワーク
シグナル経路・遺伝子発現・代謝物層にまたがる大規模ネットワークのこと。↑
注2 マルチオミクス計測
生体分子を網羅的に計測することを、オミクス計測と呼ぶ。生体分子は物性が大きく異なる分子種を多く含むため、それぞれの分子種に適した計測法を選択する必要がある。複数の分子種に渡るオミクス計測を行うことを、マルチオミクス計測と呼ぶ。↑
注3 メタボローム(水溶性代謝物)
生体内の水溶性の代謝物をキャピラリー電気泳動質量分析によって網羅的に計測すること。↑
注4 リピドーム(脂質)
生体内の脂質を質量分析によって網羅的に計測すること。↑
注5 トランスクリプトーム(遺伝子転写物)
生体内の転写物を次世代シーケンサーによって網羅的に計測すること。↑
注6 プロテオーム(タンパク質)
生体内のタンパク質を質量分析によって網羅的に計測すること。↑
注7 リン酸化プロテオーム(タンパク質リン酸化)
生体内のタンパク質のリン酸化状態を質量分析によって網羅的に計測すること。↑
注8 アロステリック制御
酵素の活性部位ではない部位に代謝物などが結合して活性を制御する現象のこと。↑
注9 アデノシン三リン酸(ATP)
細胞の増殖、筋肉の収縮、植物の光合成、菌類の呼吸および酵母菌の発酵などの代謝過程にエネルギーを供給するためにすべての生物が使用する化合物のこと。↑
注10 転写因子
転写を制御する因子。↑


