DATE2024.11.07 #Press Releases
腫瘍や炎症・神経活動に関わるA3受容体の薬剤選択のメカニズムを解明
発表のポイント
- RNAの代謝産物であるm6Aが結合したアデノシンA3受容体と三量体Gタンパク質Giとの複合体構造の構造解析に成功しました。
- m6A以外にもアデノシンやその修飾体、アゴニストなどの構造解析により、A3受容体の選択性について構造的・機能的に明らかにしました。
- 本研究は修飾アデノシンとA3受容体の関係に示唆を与えるのみならず、アデノシン受容体を標的とした創薬への構造的知見を与えるものです。
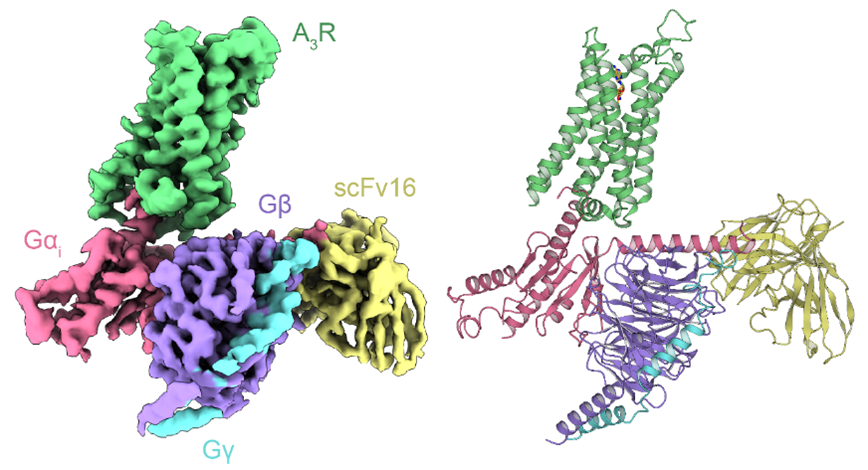
A3R-Gi複合体の全体構造
発表概要
東京大学大学院理学系研究科の濡木理教授と、東北大学加齢医学研究所の魏范研教授らによる研究グループは、アデノシン(注1)やその修飾体などによって活性化したアデノシンA3受容体と三量体Gタンパク質Gi(注2)とのシグナル伝達複合体の立体構造をクライオ電子顕微鏡(cryo-EM)(注3)による単粒子解析(注4)によって決定しました。
A3受容体は、がん細胞や免疫細胞で多く見られ、新たな薬剤標的として注目されています。特に、修飾アデノシン(注5)であるm6A(注6)という修飾アデノシンがアデノシン受容体の中でもA3受容体を選択的に活性化することが知られていましたが、その詳しい仕組みは分かっていませんでした。 今回の研究では、m6Aに結合したA3受容体と三量体Gタンパク質Giとの複合体構造を決定し、また新たにi6A(注7)という修飾アデノシンがA3受容体を選択的に活性化することを発見しました。また、A3受容体は他の受容体にはない疎水性のポケットを持っており、選択的な薬剤はこのポケットと結合することで効果を発揮することを明らかにしました。
この成果は、A3受容体を標的とした新しい薬の開発に繋がり、がんや炎症の治療に貢献することが期待されます。
発表内容
研究の背景
RNAの構成因子として知られるアデノシンは、生体内においてシグナル伝達物質としても働き、その役割はGタンパク質共役型受容体ファミリー(GPCR)(注8)に属するアデノシン受容体との結合によって果たされます。アデノシン受容体はA1,A2A,A2B,A3の四つのメンバーから構成され、それぞれが生体内で異なる役割を持ち合わせています。
アデノシン受容体の中でも、A3受容体は腫瘍細胞や免疫細胞において活発に発現しています。そのため、A3受容体はナモデノソンのような選択的薬剤が開発されるなど、医学的・薬学的興味を集めてきました。さらに近年、修飾されたRNAの代謝産物であるm6Aという修飾アデノシンの一種がアデノシン受容体の中でもA3受容体を強力に活性化させて免疫応答を引き起こすことが明らかになり、修飾アデノシンとA3受容体の関係も注目されていました。
しかしながら、m6Aの他にA3受容体を選択的に活性化する修飾アデノシンが存在しているかどうかは未だ明らかになっていませんでした。さらに、アデノシン受容体の中でもA3受容体は構造が明らかにされておらず、A3受容体が選択的に活性化される詳細なメカニズムも不明のままでした。そこで、今回の研究ではこれらの問題を解き明かすことを目標としました。
研究の内容と成果
本研究では、修飾アデノシンを用いたスクリーニング(注9)によって、m6Aのほかに新たにi6Aという修飾アデノシンがA3受容体を選択的に活性化させることを明らかにしました。i6Aは、m6A同様アデンシンのN6位に修飾を持つ修飾アデノシンの一種です。m6AはメッセンジャーRNA(mRNA)と リボソームRNA(rRNA)などさまざまなRNA種に存在する修飾ですが、i6Aは特定のトランスファーRNA(tRNA)に特異的に存在するRNA修飾であり、哺乳動物においては細胞増殖抑制効果があることが知られています。興味深いことに、N6位に修飾を持つ修飾アデノシンは他にもt6Aなどがありますが、その中でも疎水的な修飾をもつm6Aとi6AのみがA3受容体への活性を示しました。そのため、修飾部位の疎水的な特性がA3受容体への活性と深い関係を持つことが示唆されました(図1)。
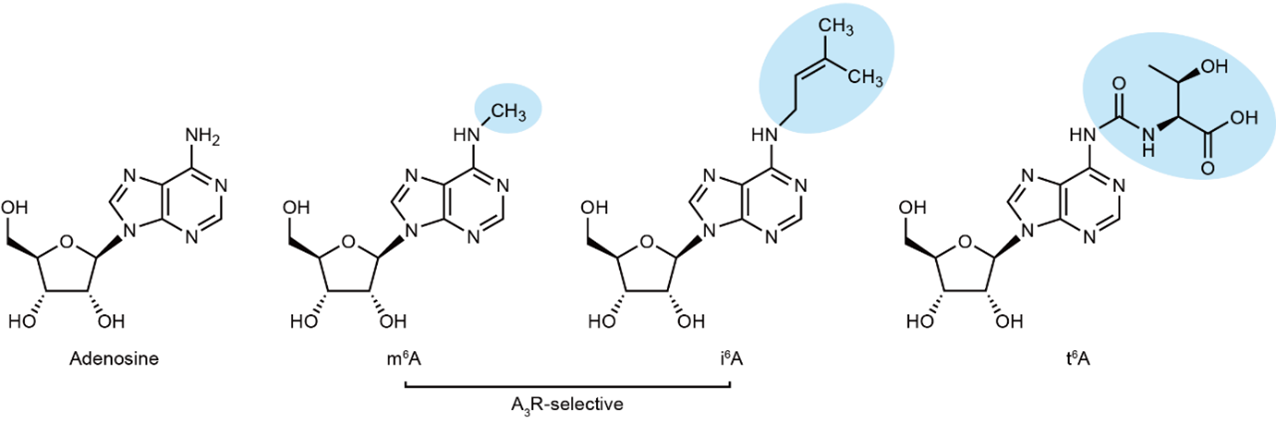
図1:アデノシンと修飾アデノシン
N6位に疎水性の修飾を持つm6Aとi6AのみがA3受容体選択的な活性を示しました。
それぞれのN6位の修飾が青く囲まれています。
さらに、クライオ電子顕微鏡を用いた単粒子解析法によって、アデノシン受容体ファミリー全体を非選択的に活性化させるアデノシンとNECA(注10)が、さらにA3受容体を選択的に活性化させるm6A, i6A, ナモデノソンが結合したA3受容体と三量体Gタンパク質Giとの複合体の立体構造をそれぞれ決定しました(図2)。
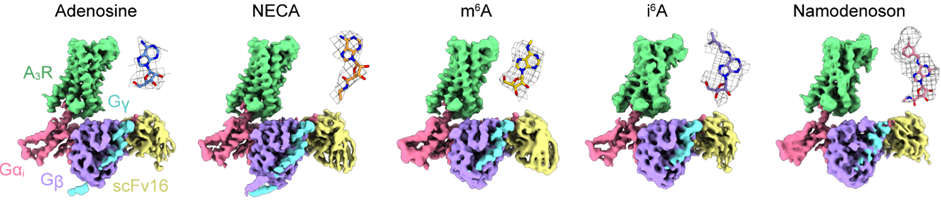 図2:各作動薬が結合したA3-Gi複合体の全体構造
図2:各作動薬が結合したA3-Gi複合体の全体構造
それぞれの薬剤は、アデノシンと共通した骨格を持つ部分ではそれぞれ他アデノシン受容体と同様の相互作用様式を示していました(図3)。一方で、他のアデノシン受容体では水素結合を形成しているグルタミン酸がA3受容体には存在しておらず、代わりにその周辺に疎水性のポケットが存在していました。
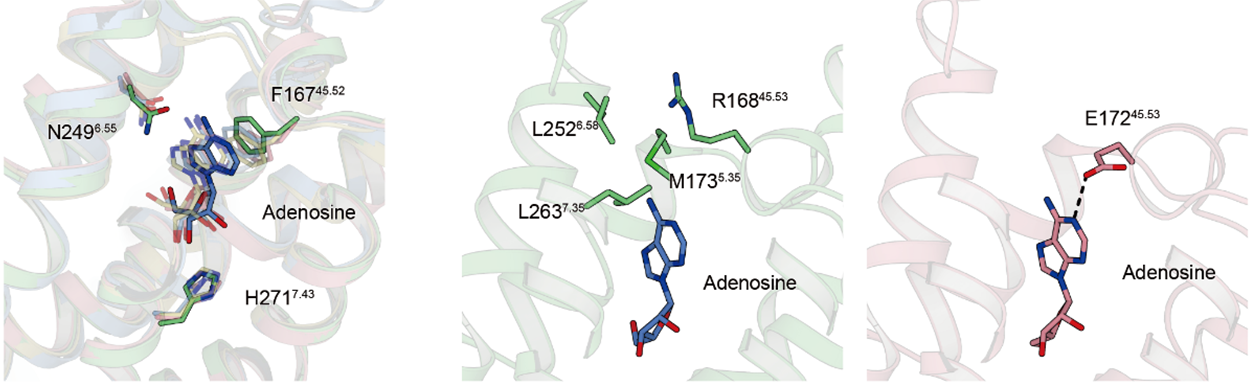
図3:アデノシン部分の相互作用の比較
アスパラギン(N)やヒスチジン(H)との水素結合、フェニルアラニン(F)とのπ-π相互作用など、他のアデノシン受容体と同様の相互作用を示す一方で(左)、A3受容体には(中)、他のアデノシン受容体ではアデノシンと水素結合を形成するグルタミン(E)が存在しないかわりに(右)、疎水性のアミノ酸で構成された疎水性のポケットが存在していることが分かりました。
この疎水性ポケットはA3受容体選択的な薬剤と疎水性相互作用(注11)を形成しており、これこそがA3受容体への選択性において重要であることが明らかになりました(図4)。
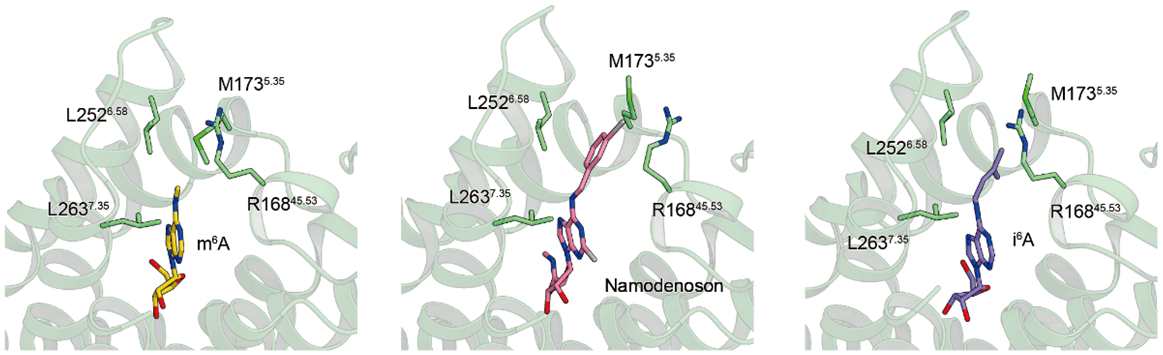 図4:A3受容体の疎水性ポケットとA3選択的作動薬の相互作用
図4:A3受容体の疎水性ポケットとA3選択的作動薬の相互作用
いずれの作動薬も、N6位の修飾がA3受容体の疎水性ポケットと相互作用することが明らかになりました。
また、A3受容体の構造が明らかになったことで、それぞれのアデノシン受容体に選択的な薬剤の結合様式についての比較が可能となりました(図5)。いずれの薬剤も受容体内部のアデノシンが結合するポケットと相互作用している一方で、それぞれが細胞外側の領域と相互作用していることがわかりました。アデノシン受容体ファミリーの膜貫通領域は配列相同性(注12)が高いですが、細胞外側の領域については配列が多様です。アデノシン受容体選択的な薬剤は、これらの多様な領域との相互作用によって特定の受容体への選択性を獲得していることが示唆されます。
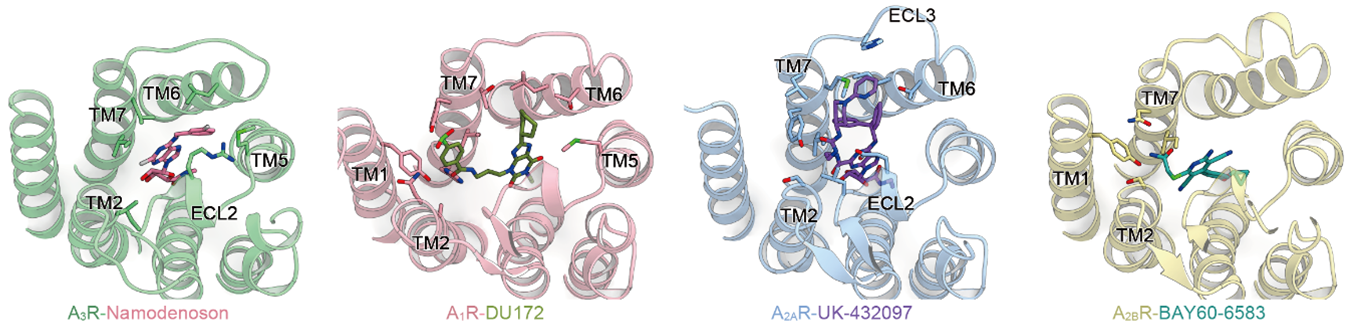
図5:アデノシン受容体とその選択的薬剤の結合様式
N6位に疎水性の修飾を持つm6Aとi6AのみがA3受容体選択的な活性を示しました。
本研究の成果は、修飾アデノシンとA3受容体の関係について新たな手掛かりを提供し、さらにA3受容体の選択性について示唆を与えるものです。A3受容体の選択性メカニズムの理解が深まることで、より効果的で選択的な薬剤の設計が可能となり、創薬研究への貢献が期待されます。また、未だ謎の多い修飾アデノシンとA3受容体の関係において、本研究の成果は重要な分子生物学的・構造生物学的基盤を提供します。
論文情報
-
雑誌名 Nature Communications 論文タイトル Structural insights into the agonist selectivity of the adenosine A3 receptor著者 Hidetaka S. Oshima, Akiko Ogawa, Fumiya K. Sano, Hiroaki Akasaka, Tomoyoshi Kawakami, Aika Iwama, Hiroyuki H. Okamoto, Chisae Nagiri, Fan-Yan Wei*, Wataru Shihoya*, Osamu Nureki*
(*責任著者)DOI番号 10.1038/s41467-024-53473-1
研究助成
本研究は、日本学術振興会における科学研究費助成事業の基盤S「生体環境でのGPCRの構造ダイナミクス」(課題番号:21H05037 研究代表者:濡木 理)や基盤B「クライオ電子顕微鏡法を用いたGPCR創薬研究」(課題番号:22H02751 研究代表者:志甫谷 渉)の一環で行われました。また、本研究は、AMED「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。また、科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「鈴木RNA修飾生命機能プロジェクト」(課題番号:JPMJER2002 研究総括:鈴木勉)創発的研究支援事業(FOREST)「エピトランスクリプトームが開拓する新しい眼内病態生理学」(課題番号:JPMJFR220K 研究代表者:小川亜希子)の支援を受けて行われました。
用語解説
注1 アデノシン
アデニンとリボースからなるヌクレオシド。RNAを構成する四種類のヌクレオシドの中の一つであることに加え、アデノシン受容体と結合してシグナル伝達物質として働くほか、cAMPやATPなど、別のエネルギー伝達物質やシグナル伝達物質の材料ともなる。↑
注2 三量体Gタンパク質Gi
Gタンパク質は、細胞内情報伝達に関わるGTP結合タンパク質であり、Gα、Gβ、Gγ、サブユニットの三量体により構成されている。活性化されたGタンパク質共役受容体と結合したGタンパク質三量体では、GDP-GTP交換反応が起き、GαとGβ-Gγの二つに解離する。解離したサブユニットが下流のシグナル伝達因子と結合し活性化することで、細胞にさまざまなシグナル応答が生じる。Gαサブユニットは大きくGs、Gi、Gq/11、G12/13の四種類に分別され、特にGiは、下流で細胞内cAMP濃度を低下させることでさまざまなシグナルを伝える。↑
注3 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸をはじめとする生体高分子の像を多数撮影することで立体構造の決定を行う、単粒子解析法に用いられる。↑
注4 単粒子解析
多数の均一な粒子を観察、撮影し、画像処理によって粒子の詳細な構造を得る手法。単一の撮影像よりも分解能を向上させることができるほか、さまざまな方向を向いた粒子を撮影することで、三次元立体構造を把握することが可能となる。↑
注5 修飾アデノシン
アデノシンの各部位に化学修飾が施されたアデノシン。アデノシンを含め、修飾ヌクレオシドの役割は近年注目を集めている。↑
注6 m6A(N6-メチルアデノシン)
アデニンN6位の窒素原子がメチル化された分子。mRNAに存在するm6A修飾がmRNAの局在や安定性、翻訳効率を制御しさまざまな生命現象に関わる。その一方で、修飾を受けたRNAが分解・代謝された後にその産物が細胞外へ分泌されることが近年明らかになり、中でもm6AはアデノシンA3受容体を強力に活性化することを著者らのグループが報告した。↑
注7 i6A(N6-イソペンテニルアデノシン)
アデニンN6位の窒素原子がイソペンテニル化された分子。哺乳動物では特定のtRNAのアデノシンがtRNA isopentenyltransferase1(TRIT1)という酵素によって修飾されることで生成される。ミトコンドリア病患者の一部ではTRIT1遺伝子変異を有することが知られている。↑
注8 Gタンパク質共役受容体(GPCR)
GPCRは細胞膜に発現する膜タンパク質で、膜を貫通する7本のαヘリックスで構成されている。膜受容体タンパク質のなかで最大のファミリーを形成し、細胞外領域で特定のリガンドが結合することで活性化し、細胞内の三量体Gタンパク質を活性化することでシグナルを伝達する。体内で多様な生理作用の調節に重要な役割を果たすことから、既承認薬の30%以上がGPCRを標的にした薬剤になっている。↑
注9 スクリーニング
さまざまな分子や薬剤に対して試験を行うことで、ある条件を満たすものだけを選抜する手法のこと。本研究では、修飾ヌクレオシドに対して、それぞれのアデノシン受容体を活性化させられるかどうか調べることで目的の分子が選抜された。↑
注10 NECA
5'-N-エチルカルボキシアミドアデノシンの略称。NECAは5'位に修飾が施された修飾アデノシンの一種であり、アデノシン受容体ファミリーの全てを無差別にかつ強力に活性化するため、A3受容体以外のアデノシン受容体の構造解析にも用いられてきた。↑
注11 疎水性相互作用
疎水的な側鎖を持つアミノ酸が形成する、非極性の相互作用。例えばロイシンやイソロイシンといったアミノ酸は側鎖が非極性であるため、極性を持つ水とは反発する一方で、同じく疎水的なアミノ酸と疎水性相互作用を形成する。↑
注12 配列相同性
タンパク質を構成するアミノ酸配列の一致度のこと。配列相同性が高い領域はその役割も似ていることが多く、逆に配列相同性が低い領域はそれぞれのタンパク質にとって特徴的な役割に関与していることがある。↑


