化学と生物の二刀流でK+イオンを光らせる
寺井 琢也(化学専攻 准教授)
Robert E. Campbell(化学専攻 教授)
生物の体は,さまざまなタンパク質や低分子代謝物,イオンなどからできており,
それらの時間的・空間的変化を測定することは生命現象の分子レベルでの解明に不可欠だ。
標的物質と結合することで蛍光を放つ「蛍光センサー」は,
そのための有用な道具として生物学・医学研究で広く使われている。
われわれは,有機合成分子とタンパク質の複合体を指向性進化させることで,
細胞内の主要イオンの一つであるカリウムイオン(K+)を認識して赤く光る,
高性能な蛍光センサーを開発した。
赤の光は青や緑より生体組織を通りやすいため,
生体深部でのK+の役割を解明するのに役立つと期待される。
![]()
生物を研究する上で,顕微鏡を用いた細胞観察はもっとも基本的な方法の一つだ。注目する物質がタンパク質の場合,蛍光タンパク質と遺伝子的に融合させることで,その存在場所や動きが比較的簡単に解析できる。しかし,この方法では低分子代謝物やイオンの動きを知ることはできない。そこで力を発揮するのが蛍光センサーだ。これは特定の標的と結合・反応したときに蛍光の強さや色が変わるよう設計された機能性分子のことで,こうしたセンサーを細胞に導入することにより,生きた細胞の中で感度よく標的物質を可視化(イメージング)できる。
しかし,蛍光センサーの開発研究は1980年代から行われているものの,高性能かつ実用的なセンサーが報告されている標的は意外と少ない。こうした状況を打破するには,新しいセンサーの基本骨格や開発手法が必要と考えられる。そこで最近注目されているのが,合成低分子(=化学物質)とタンパク質(=遺伝子産物)の複合体を用いる「化学遺伝学(chemigenetic)」という手法だ。
本研究では,この化学遺伝学を活用し,細胞内に最も豊富に存在する陽イオンであるK+に対する高性能センサーを開発した。具体的にはまず,大腸菌由来のカリウム結合タンパク質 (Kbp)と,周辺微小環境(疎水性の度合い,水素結合の存在など)に依存して蛍光強度が変わる赤色蛍光分子JF635を,クロロアルカンを持つ低分子と選択的に共有結合するHaloTagというタンパク質を介して組み合わせた複合体センサーを設計した。次いでさまざまなプロトタイプを作って試すことで,K+の濃度に応じて蛍光を放つ複合体分子を見出した。さらに,タンパク質に少しずつ異なる変異を導入した集団を作っては,その中から最適なものを選び出す過程を10回以上にわたって繰り返すことで(=指向性進化),蛍光変化の大きさや明るさを改良していった。このプロセスには多くの時間と労力を要したが,最終的に得られたセンサーHaloKbp-1a635は,組織レベルでの観察に適した赤色の蛍光を持つのみならず,既存のK+センサーより明るく,蛍光変化幅が大きいという特徴を持った。これは有機合成分子の持つ優れた蛍光特性と,指向性進化が可能というタンパク質の特徴を併せ持つ,化学遺伝学センサーの強みを活かした結果といえる。さらに,センサーのX線結晶構造解析や生細胞イメージングにも成功した(図)。
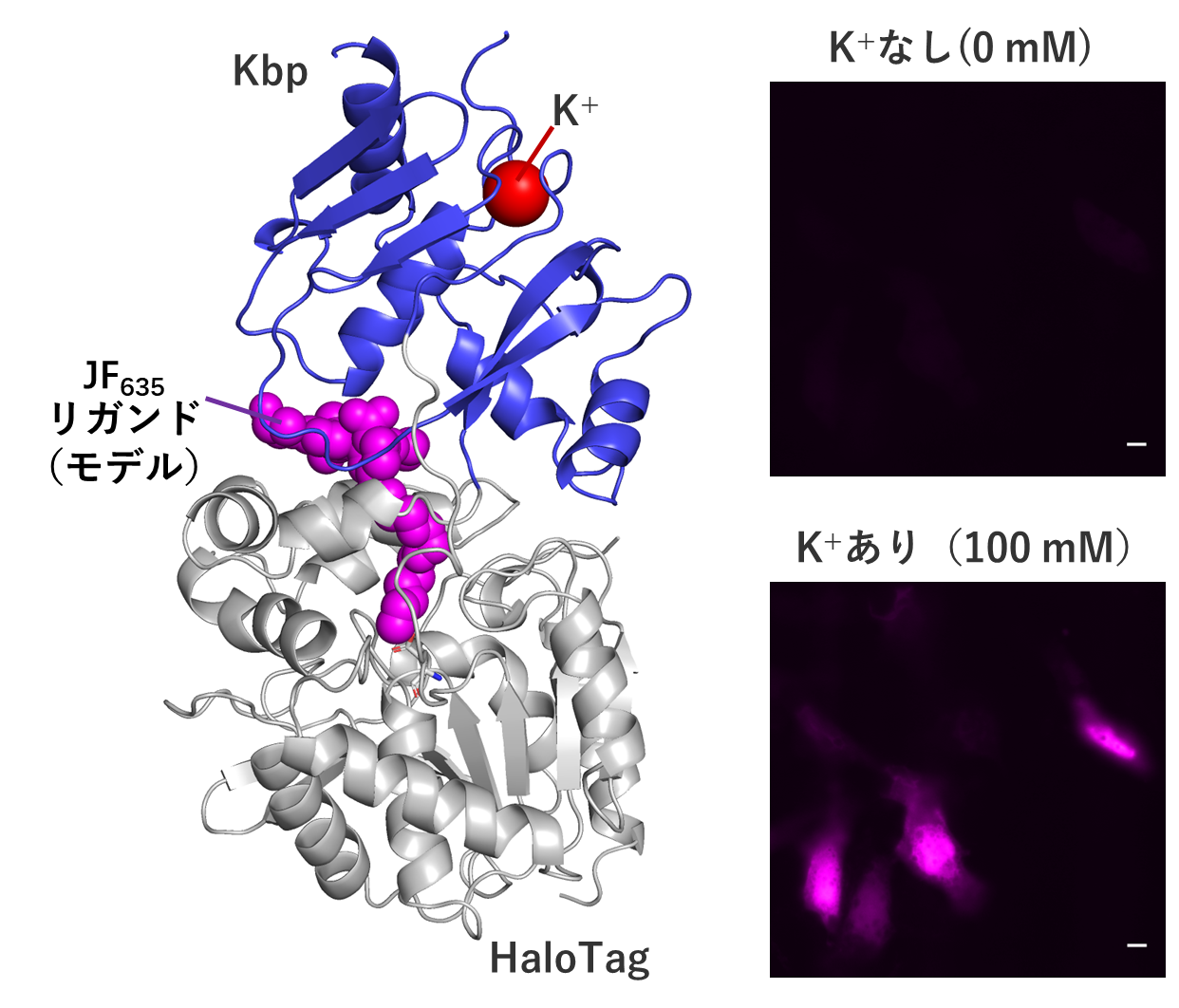 X線結晶構造解析から明らかになったセンサーの構造(左)と,センサーによるK+の細胞イメージング(右)。スケールバーは10 μm
X線結晶構造解析から明らかになったセンサーの構造(左)と,センサーによるK+の細胞イメージング(右)。スケールバーは10 μm化学と生物の二刀流ともいえる化学遺伝学センサー開発は,世界的に端緒についたばかりで,多くの可能性を秘めている。本研究で得られた知見は,今後の類似のセンサー開発に大いに活用できると考えられる。またK+は細胞の膜電位制御や神経活動などの生理現象のほか,高血圧や不整脈などの疾患ともかかわりが深く,本センサーがこうした研究の発展に少しでも貢献できれば幸いである。
本研究成果は,D. Cheng et al., J. Am. Chem. Soc., 146, 35117(2024)に掲載された。またJournal Supplementary Coverにも選出された。


