DATE2021.03.02 #Press Releases
ゲノム上に密に並んだ遺伝子の転写を調節する仕組み
稲垣 宗一(生物科学専攻 准教授)
大矢 恵代(生物科学専攻 博士課程2年)
角谷 徹仁(生物科学専攻 教授)
発表のポイント
- シロイヌナズナのヒストン脱メチル化酵素FLDは、転写が両方向に起きている遺伝子領域において働き、転写を調節することが明らかになりました。
- 両方向性の転写はゲノムワイドに数多くの遺伝子で見られ、密なゲノム上で転写を円滑に行うための仕組みの一端が明らかになったと考えられます。またこの仕組みは、植物が適切な時期に花を咲かせる仕組みに利用されていることも明らかになりました。
- 本研究はゲノムの機能と生命現象の制御におけるエピゲノム(注1)の新たな機能を示し、今後その進化的保存性や詳細なメカニズムが解明されていくことが期待されます。
発表概要
生物のゲノム上ではタンパク質をコードする遺伝子のみならず、タンパク質をコードしない非コード領域においても転写されており、ゲノム上のほとんどの領域で転写が起きていることが分かってきていますが、その役割や制御機構は大部分が未解明です。特に、ゲノム上で近接していたり、オーバーラップしていたりする遺伝子同士の転写を調節する仕組みは分かっていませんでした。
東京大学大学院理学系研究科の稲垣宗一准教授、大矢恵代大学院生、角谷徹仁教授らは、ゲノムが小さく、遺伝子が密に並んでいるシロイヌナズナという植物を用いた研究の結果、数百もの遺伝子領域において逆向きにオーバーラップする転写が起きていること、またこの両方向性の転写が起きている領域の転写を調節する新たなクロマチン制御機構を見出しました。面白いことにこの両方向性の転写を介した遺伝子の制御は、植物が冬を経験したあとの春に花を咲かせる仕組みに関与していることが明らかになりました。本研究の成果は、ゲノム上での近隣遺伝子との関係性が遺伝子の制御に与える影響を示唆しており、今後そのメカニズムの理解につながることが期待されます。
発表内容
遺伝子はメッセンジャーRNAに「転写」され、タンパク質に「翻訳」されることで機能していますが、ゲノム上にはこのような通常の遺伝子(タンパク質を「コードする」と言われる)に加えて、転写されるが翻訳されない「非コードRNA」も大量に存在していることが近年の大規模解析から分かってきました。非コードRNAの一部はRNAの形で機能を持ち、遺伝子発現制御やゲノムの機能に重要な役割を持つことが分かっていますが、全く機能未知のRNAもたくさん存在しています。このように、ゲノム上では「密に」転写が起きており、ゲノム上で近くにある遺伝子(もしくは非コードRNA)同士の転写を調整する仕組みがあることが予想されますが、その仕組みに関してはまだほとんど解明されていません。
本研究では、モデル植物であるシロイヌナズナを用いて、遺伝子の転写される領域に局在するヒストン修飾(注2)、ヒストンH3タンパク質の4番目のリジン残基のモノメチル化(メチル基が一つついた状態;H3K4me1と呼ぶ)に着目した研究を行いました。研究グループでは以前に、遺伝子の転写領域のH3K4me1の制御が遺伝子の活性化に果たす役割を見出していました(Inagaki et al 2017)。そこでさらにH3K4me1の制御メカニズムと機能を探るために、H3K4me1を除く酵素(脱メチル化酵素)を探索しました。そのなかで、植物から微生物、ヒトに至るまで真核生物に広く保存されたlysine-specific demethylase 1 (LSD1)という酵素遺伝子の一つ、FLOWERING LOCUS D (FLD)と名付けられていた遺伝子に注目しました。ゲノム全体におけるヒストン修飾パターンを調べることができるChIP-seq法(注3)を用いてH3K4me1のパターンを調べた結果、FLDの機能喪失変異体において野生型植物と比べてH3K4me1がより蓄積している領域が見いだされました。一方でFLDタンパク質自身がゲノム上で存在している場所を同じくChIP-seq法で調べたところ、変異体でH3K4me1が蓄積している領域に存在していました。すなわち、FLDタンパク質はこのような領域でH3K4me1を除いていて、FLDタンパク質が働けない変異体においては、H3K4me1が蓄積してしまうということが分かりました。
興味深いことに、FLDの変異体においてH3K4me1が蓄積する遺伝子の多くは、すぐ下流(遺伝子の後方)に逆向きの遺伝子が存在しているコンバージェント遺伝子であることが分かりました(図1)。
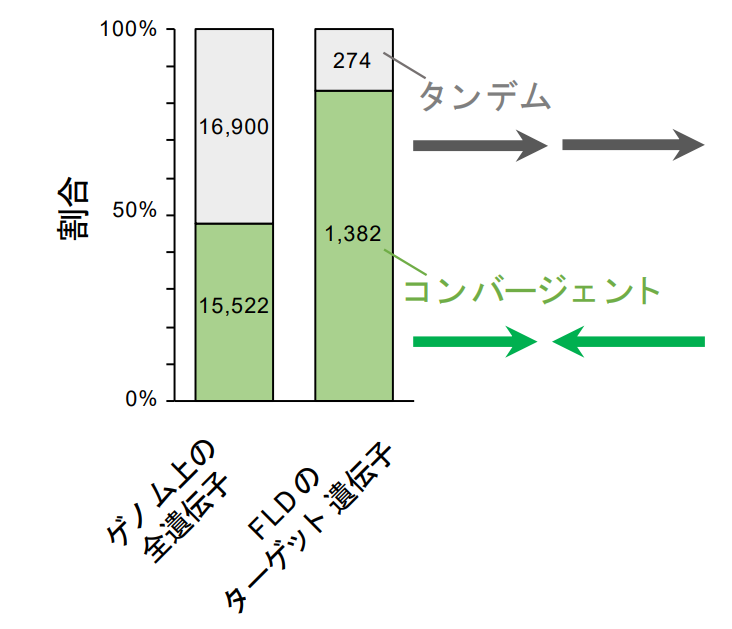
図1:FLDで制御される遺伝子はコンバージェント遺伝子が多い。
すべての遺伝子を下流の遺伝子との関係で、同じ向きの「タンデム」と逆向きの「コンバージェント」に分けられる。ゲノム上の全遺伝子ではおよそ半分がコンバージェン トだが、FLDで制御される遺伝子はほとんどがコンバージェントである。
更に解析を進めた結果、このような領域では下流のコンバージェント遺伝子から転写のリードスルー(注4)が起きた結果、逆向きの転写(アンチセンス転写(注5))が起きていることが明らかになりました。つまりFLDが働いている領域では通常の遺伝子の転写(センス転写)に加えて、アンチセンス転写も起きており、転写が両向きに起きていました(図2)。
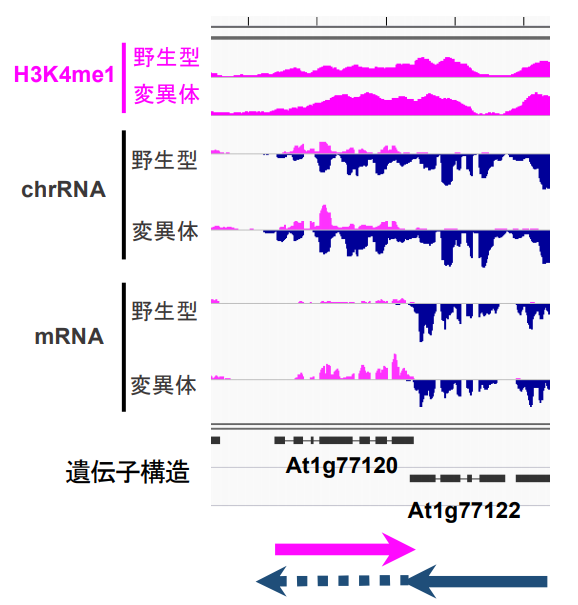
図2:FLDで制御される遺伝子では両向きの転写が起きている。
一番上のH3K4me1は、ChIP-seqの結果で、グラフの色がついた部分の高さがH3K4me1の量を表している。野生型に比べてFLDの変異体ではAt1g77120という遺伝子の領域においてH3K4me1が増えている。一番下のmRNAはメッセンジャーRNAの発現レベルを表す。ピンクのグラフが右向きに転写したRNAを、紺色のグラフが左向きに転写したRNAを表す。真ん中のchrRNAは転写を直接的に調べる方法で調べたRNAを表す。chrRNAではAt1g77122遺伝子が、At1g77120遺伝子の領域まで転写をしていて(下図の破線矢印で表す)、At1g77120遺伝子領域では転写が両向きに起きている事がわかる。
両向きの転写が起きている領域でFLDがH3K4me1を除くことの意義を探るために、FLDの変異体におけるゲノムワイドな転写パターンを詳細に解析した結果、FLDの変異体ではH3K4me1の上昇に伴って転写量が増加および転写伸長速度が速まっていることが見いだされました。また、FLDの欠損が転写に及ぼす影響の一部はDNAのらせん構造を保つ酵素DNAトポイソメラーゼIの欠損変異体によって打ち消されることが明らかになりました。このことは、両向きの転写が起きることによるDNAのねじれ(スーパーコイル(注6))が本制御と関係していることを示唆しています。これらの結果から、遺伝子が密に並んだゲノム上において、近接する遺伝子同士の衝突や絡まりを防ぐ仕組みの一端を、FLDによるヒストン修飾除去を介した転写ダイナミクスの制御が担っているというモデルを提唱しました(図3)。
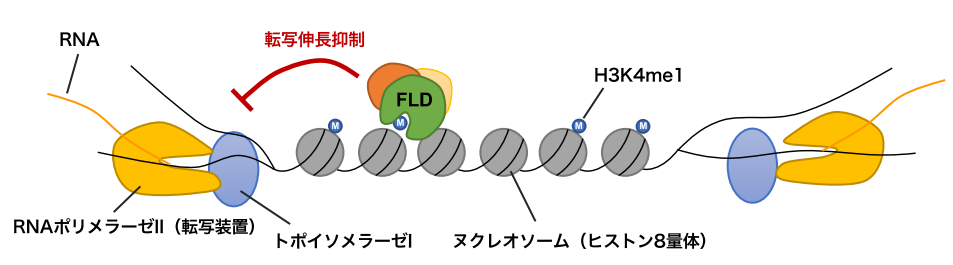
図3:FLDによる制御モデル。
RNAポリメラーゼIIはDNA二本鎖をほどきながら遺伝子の転写を進める。トポイソメラーゼIは転写装置と協調して働き、DNAのねじれをほどき、転写の進行(転写伸長)を助ける。遺伝子の転写領域にはH3K4me1が局在しているが、両方向から転写するような遺伝子の場合、FLDがH3K4me1を除くことで転写の伸長を抑制し、両方向からの転写を円滑にしているのではないかと考えられる。
また、FLDはこれまでに植物の花成制御(注7)に関わっていることが知られていました。興味深いことに、FLDはFLOWRING LOCUS C(FLC)という花成制御の中心的遺伝子の転写を抑制することで花成を制御することが知られていましたが、本研究により、FLDはFLC領域のH3K4me1を除くことでその転写を抑制していることが明らかになりました。またこの制御にはFLC領域で転写されるアンチセンスRNAが重要な役割を果たしていることから、本研究で見いだされた両向き転写によって駆動されるクロマチン制御機構が、植物が適切な時期に花を咲かせる仕組みに「利用されている」と考えられます(図4)。

図4:FLDとトポイソメラーゼによる花成制御。
FLDの欠損変異体ではFLC遺伝子の抑制が効かなくなり、花が咲くのが遅くなる。トポイソメラーゼI(TOP1α)遺伝子の欠損によりFLC遺伝子の転写活性化が弱まるため、FLDとTOP1αの二重変異体ではFLDの変異体に比べて花が咲くのが早くなる。
本研究により明らかとなった、密なゲノム上の遺伝子の転写を調整する機構は、他の生物にも保存されている可能性が高いと考えられ、ゲノムの正常な機能に重要な役割を果たすと考えられます。また本研究を手掛かりとして、花成のような生命現象の制御に非コードRNAを介した転写制御が果たす役割の理解とそれを基盤とした生命現象の人為的制御の開発が進むと期待されます。
本研究は科学技術振興機構(JST)、さきがけ(研究代表者:稲垣宗一)およびCREST(研究分担者:角谷徹仁)などの支援を受けて行われました。
発表雑誌
-
雑誌名 Nature Plants 論文タイトル Chromatin-based mechanisms to coordinate convergent overlapping transcription 著者 Soichi Inagaki*, Mayumi Takahashi, Kazuya Takashima, Satoyo Oya, Tetsuji Kakutani DOI番号 10.1038/s41477-021-00868-3 アブストラクトURL https://dx.doi.org/10.1038/s41477-021-00868-3
用語解説
注1 エピゲノム
生物の持つゲノム情報はDNAの塩基の並び順によるが、エピゲノム情報はDNAメチル化やヒストン修飾などの付加情報のことを指し、遺伝子の発現制御や染色体の挙動などに影響を与え、さまざまな生命現象に重要な役割を果たす。ゲノム情報に比べると可変性だが、世代を超えて継承されることもあり、エピジェネティクスの基盤となる。 ↑
注2 ヒストン修飾
ヒストンはゲノム中でDNAが巻き付いているタンパク質複合体で、その翻訳後修飾(メチル化、アセチル化、リン酸化など)は局所的なDNAの高次構造などに変化をもたらす。代表的なエピゲノム情報である。 ↑
注3 ChIP-seq法
免疫沈降(Chromatin Immunoprecipitation; ChIP)は、特定のタンパク質やタンパク質の修飾に対する抗体を用いて、それらが存在しているゲノム上のDNAを回収する技術。回収したDNAを大規模DNAシークエンスにかけることで、ゲノム上でタンパク質やその修飾の存在する位置を調べることができる。 ↑
注4 リードスルー
遺伝子が正常な位置で転写を終了せず(終止点をスルーする)、転写をし続けてしまうこと。 ↑
注5 アンチセンス転写
タンパク質をコードする遺伝子の転写の向き(センス向き)とは反対の向きに転写が起きること。それによって生じたRNAをアンチセンスRNAと呼ぶ。 ↑
注6 スーパーコイル
DNAは二重らせん構造をとっているが、転写や複製時に二重らせん構造を開くと、部分的にねじれが強くなり過度な巻き付きが起きる。この構造のことを超らせんあるいはスーパーコイルと呼ぶ。DNAトポイソメラーゼはスーパーコイルを解消するためにDNAを一度切断し、そのねじれを解く酵素である。 ↑
注7 花成制御
植物が花を咲かせる時期を決める仕組み。温度や日周などのさまざまな要因が花成制御に関係するが、シロイヌナズナにおいては、冬の低温がFLC遺伝子の発現をエピジェネティックに抑制することが春に花を咲かせることに関わっている。↑


