DATE2025.04.22 #Press Releases
投げ縄ペプチドが受容体の働きを抑制する仕組みを可視化
—— 免疫療法抵抗性を示すがん治療応用への期待——
発表のポイント
- 人体にある重要な細胞表面タンパク質(ETB受容体)と、投げ縄様の独特な構造を持つラッソペプチド「RES-701」がどのように結合するか、クライオ電子顕微鏡で明らかにしました。
- このペプチドは、ETB受容体内の特定の隙間にしっかりと入り込み、受容体が通常行う細胞内への信号伝達を阻害することがわかりました。
- これにより、ラッソペプチドの高い選択性と安定性が、ETB受容体を標的とした新規創薬戦略に応用できる可能性が示唆されます。
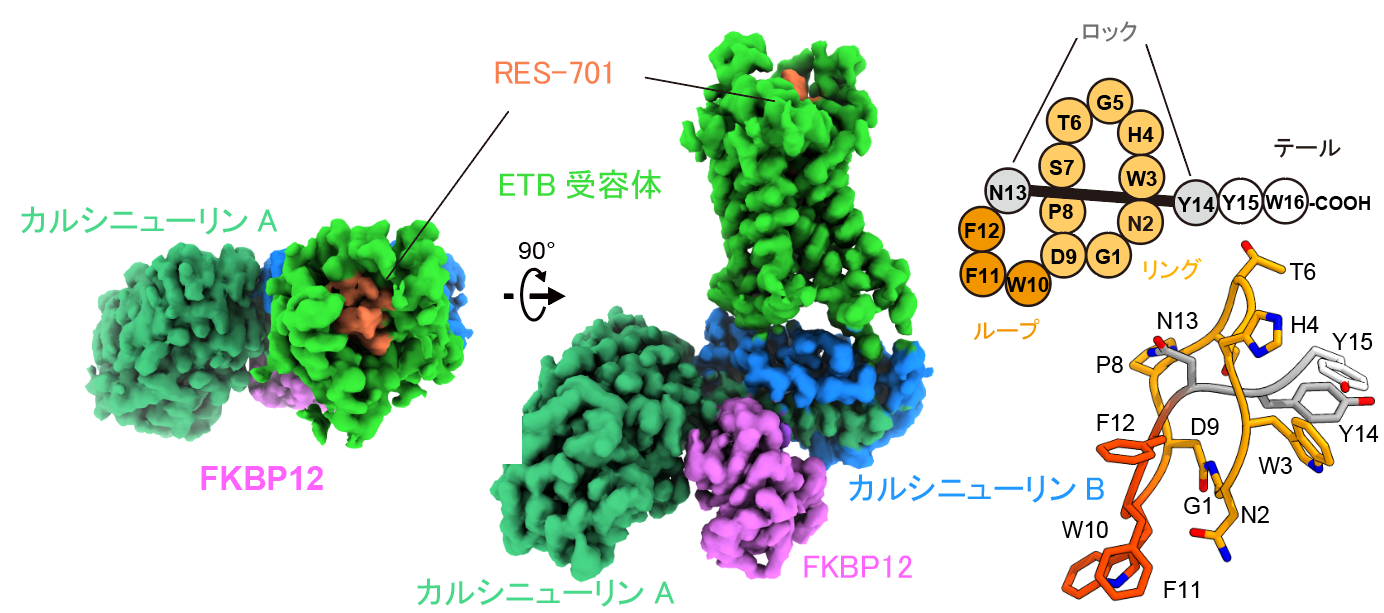
投げ縄ペプチドRES-701が結合したETB受容体の構造
発表概要
慶應義塾大学医学部坂口光洋記念講座(シグナル探求学)の志甫谷渉准教授(研究当時:東京大学大学院理学系研究科 助教)、東京大学大学院理学系研究科の濡木理教授およびLassogen Incらによる研究グループは、細胞表面に存在するGタンパク質共役受容体(GPCR)(注1) の一つであるETB受容体(注2) に対するラッソペプチド(注3) RES-701の結合構造をクライオ電子顕微鏡(cryo-EM)(注4) による単粒子解析(注5) によって決定しました。GPCRの1つであるETB受容体は血管の働きを調整することや、がんの血管新生や免疫反応に関わることが知られており、難治性がんの治療標的として注目され、治療薬開発が待ち望まれています。しかし、これまでの開発では、十分な機能調節活性、選択性が発揮できる低分子化合物を得ることはできませんでした。ラッソペプチドの一つであるRES-701はGPCRの1つであるETB受容体に対して既存の薬剤より高い選択性をもち、逆作動薬としての有望性が示される一方で、ETB受容体へ作用する仕組みの解明が今後の創薬応用への課題でした。
今回の研究では、カルシニューリン融合法 (注6) を応用することで、従来困難だったRES-701結合型のETB受容体の構造決定に成功し、ペプチドが受容体内部の特定の疎水性ポケットに結合する様子を可視化しました。この結合により、Gタンパク質と受容体との相互作用に必要な構造変化が阻害され、逆作動薬活性が実現されることが分かりました。
この成果は、ETB受容体をターゲットとするラッソペプチドを基にした医薬品開発の道を切り拓くものであり、特に免疫療法抵抗性を示すがん治療など、さまざまな疾患に対する応用が期待されます。
発表内容
研究の背景
ラッソペプチドという小さなタンパク質は、他のペプチドと比べて非常に頑強な投げ縄様の形をしており、そのため高温や酵素による分解にも強いという特徴があります。これまでは主に細菌から発見され、抗菌作用などで注目されていましたが、その独特な形状を活かして、ヒトのタンパク質に結合し機能を調節する薬剤としての応用が期待されています。
RES-701は1994年にStreptomyces属の細菌から見つかったラッソペプチドであり、GPCRの一種であるETB受容体の活性を阻害し、恒常的活性を下げる逆作動薬として働くことが示唆されています。ETB受容体は、血管の働きを調整したり、がんの血管新生や免疫反応に関わったりするため、活性を阻害する薬が難治性がんの治療標的として関心が高まっていますが、従来の低分子阻害薬では、ETB受容体に対しての選択性が十分ではありませんでした。そこで、より高い選択をもつRES-701が新たな治療法として注目されています。
しかしながら、RES-701が受容体にどのように結合し活性を阻害するのか、その仕組みは全くわかっておらず、RES-701を基にした創薬開発を妨げていました。そこで、RES-701がETB受容体に結合した構造の可視化に取り組みました。
研究の内容と成果
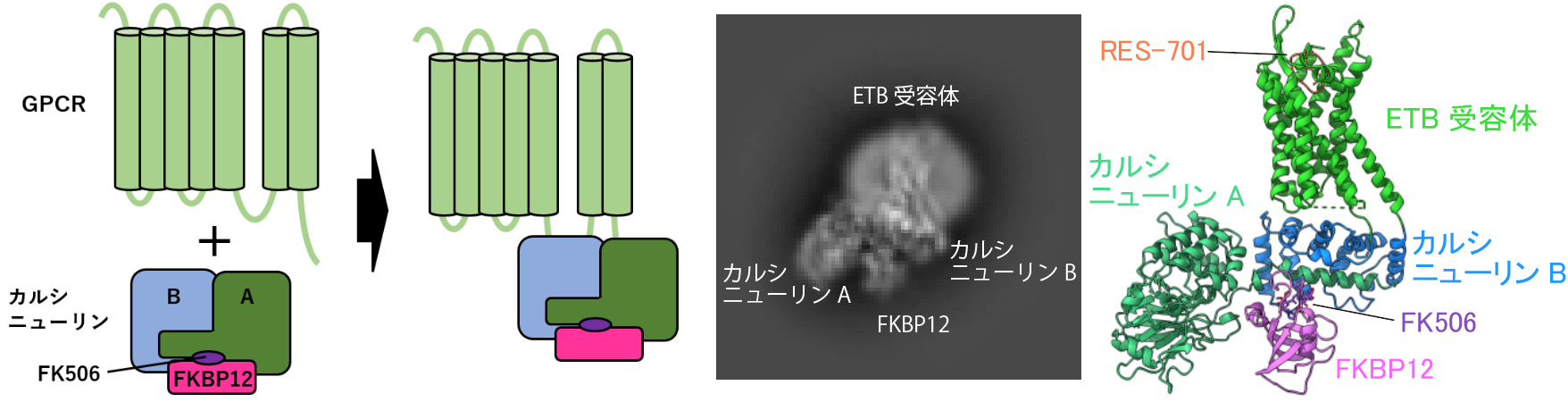
図1:カルシニューリン融合法を用いた構造決定
ETB受容体とカルシニューリンを左図のように融合したタンパク質を作製し、構造解析の際の目印となるようにしました。真ん中の二次元平均画像では、受容体に融合したカルシニューリンが明瞭に観察できます。右図は融合体の全体構造です。
そこで本研究では、RES-701結合状態のETB受容体の構造決定に取り組みました。当初X線結晶構造解析(注7) に取り組みましたが、RES-701結合状態のETB受容体は結晶化できませんでした。さらに、受容体単体は分子量が小さすぎるため、cryo-EM構造解析は困難です。そこで、ETBの細胞内第三ループやC末端にカルシニューリンという大きなタンパク質を融合することで、構造決定の際に目印にすることにしました。その結果、RES-701結合状態のETB受容体の構造を3.3 Åの分解能で明らかにすることに成功しました(図2)。
.png)
図2:RES-701の結合様式。
RES-701は左図のようにRing, Loop, Lock, Tailから構成されています。受容体とはLoop部分をポケット奥に向ける形で相互作用しており、TailのC末端側は細胞外側を向いています。
RES-701は、イソペプチド結合(注8) で形成されたリングを自身のC末端が入り込んだ、投げ縄構造をとっています。N13やY14といった側鎖が大きなアミノ酸残基よって、投げ縄がほどけないように「ロック」されています。RES-701は全体がETB受容体のポケットに入り込みETB受容体のポケットに位置するアミノ酸との様々な相互作用が確認されました。特に、独特の投げ縄構造によって形成されたループ領域(W10, F11, F12)の芳香族アミノ酸残基(注9) は、ETB受容体のポケットの底に存在する「疎水性の高い領域にはまり、ETB受容体のアミノ酸と疎水性相互作用を持っていました(注10) 。これらの残基を変異させたペプチドはETBへの活性を失うことから、ラッソペプチドのループ領域がETBへのnMオーダーの高い結合親和性を実現していることがわかりました。
.png)
図3:逆作動薬活性の仕組み
左図は恒常活性変異体(L1923.43Q)を用いたRES-701の活性評価の結果で、濃度依存的に受容体の活性が抑制させていることがわかります。右図は受容体の何も結合していない状態(灰色)とそれぞれの薬剤が結合した状態(緑)の構造比較です。
次に、恒常活性変異体L1923.43Q(リガンド非依存的に活性化されやすい変異体)を用いることでRES-701に逆作動薬活性があることを実験的に確認しました。なぜ逆作動薬活性が生じるかを明らかにするために、作動薬であるエンドセリンが結合した活性化状態、および拮抗阻害薬ボセンタンが結合した不活性状態、化合物が何も結合してない状態のETB受容体構造と比較しました。作動薬であるエンドセリンが結合すると、受容体の外側の膜貫通ヘリックス6(TM6)が内側に動き、W3366.48の側鎖が下向きに回転します。この回転は、内部の特定モチーフでF3326.44が外向きに動く原因となり、最終的に細胞内側が開きGタンパク質が結合します。一方、低分子阻害剤ボセンタンの場合、TM6の内側への動きはごくわずかで、W3366.48の回転も物理的に抑えられます。これに対し、RES-701は結合ポケットのより広い部分を占め、受容体の構造変化全体を強力に阻止します。さらに、RES-701のW10は直接W3366.48の向きを外側に回転させ、F3326.44が外向きに変化するのをより強力に防ぐため、受容体はより不活性な状態に保たれ、恒常的な活性が低下すると考えられます。
本研究の成果によって、ラッソペプチドがヒト細胞表面のETB受容体に対して示す独自の結合様式と、その機構に基づく逆作動性が初めて明確に解明されました。これにより、従来の低分子阻害薬では困難であったETB受容体に対する高選択性の薬剤設計が可能となり、がんの血管新生や免疫応答の調節といった、難治性疾患への新規治療戦略としてのラッソペプチド応用の可能性が広がります。さらに、ラッソペプチドがヒト由来のタンパク質に結合した状態を初めて可視化できたことで、ラッソペプチドによる創薬が加速すると考えられます。
関連リンク
論文情報
-
雑誌名 Nature Communications 論文タイトル Structure of a lasso peptide bound ETB receptor provides insights into the mechanism of GPCR inverse agonism著者 Wataru Shihoya#*, Hiroaki Akasaka#, Peter A. Jordan, Anna Lechner, Bethany K. Okada, Gabriella Costa Machado da Cruz, Fumiya K. Sano, Tatsuki Tanaka, Ryo Kawahara, Rajan Chaudhari, Hiroko Masamune, Mark J. Burk*, Osamu Nureki* (#共同筆頭著者 *共同責任著者) DOI番号 s41467-025-57960-x
研究助成
本研究は、日本学術振興会における科学研究費助成事業の基盤S「生体環境でのGPCRの構造ダイナミクス」(課題番号:21H05037 研究代表者:濡木 理)や基盤B「クライオ電子顕微鏡法を用いたGPCR創薬研究」(課題番号:22H02751 研究代表者:志甫谷 渉)の一環で行われました。また、本研究は、AMED「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」(課題番号:JP22ama121012、研究代表者:濡木 理)の支援により行われました。
用語解説
注1 Gタンパク質共役受容体(GPCR)
GPCRは細胞膜に発現する膜タンパク質で、膜を貫通する7本のαヘリックスで構成されている。膜受容体タンパク質のなかで最大のファミリーを形成し、細胞外領域で特定のリガンドが結合することで活性化し、細胞内の三量体Gタンパク質を活性化することでシグナルを伝達する。体内で多様な生理作用の調節に重要な役割を果たすことから、既承認薬の30%以上がGPCRを標的にした薬剤になっている。↑
注2 ETB受容体
ETB受容体は2種類あるエンドセリン受容体のうちの一つであり、Gタンパク質共役受容体(GPCR)の一種である。血管平滑筋細胞や内皮細胞などに発現し、主に内因性リガンドであるエンドセリンとの結合を介して、血管収縮や血管拡張の調節、さらにはがんの血管新生や免疫反応の制御に関与する重要なタンパク質である。↑
注3 ラッソペプチド
ラッソペプチドは、環状部分とその末端が投げ縄状に絡み合った独特な立体構造を持つ小規模なペプチドである。高温やプロテアーゼによる分解に対して非常に安定であり、天然由来の抗菌活性や創薬の新たなモダリティとして注目されている。↑
注4 クライオ電子顕微鏡(cryo-EM)
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸をはじめとする生体高分子の像を多数撮影することで立体構造の決定を行う、単粒子解析法に用いられる。↑
注5 単粒子解析
多数の均一な粒子を観察、撮影し、画像処理によって粒子の詳細な構造を得る手法。単一の撮影像よりも分解能を向上させることができるほか、さまざまな方向を向いた粒子を撮影することで、三次元立体構造を把握することが可能となる。↑
注6 カルシニューリン融合法
カルシニューリン融合法は、分子量が小さいために構造解析が困難な受容体などに対して、大型のタンパク質であるカルシニューリンを融合する手法である。GPCRのみでは大きさや構造的な特徴が不十分であるため、粒子の向きの決定が難しく、三次元構造を取得することが非常に困難である。カルシニューリンはカルシウム結合性のタンパク質であり、A, B二つのサブユニットで構成されており、さらにFK506といった薬剤やFKBP12といったタンパク質と複合体を形成する。サブユニットを受容体の細胞内第三ループおよびC末端に融合したタンパク質として発現精製を行い、FK506やFKBP12をさらに加えることで、解析対象の全体分子量を増加させ、クライオ電子顕微鏡解析などの構造決定手法で目印として利用することで、精密な構造解析の成功率を向上させる効果がある。↑
注7 X線結晶構造解析
X線結晶構造解析は、結晶化したタンパク質にX線を照射し、得られた回折パターンから電子密度分布を算出することで、分子の三次元構造を原子レベルで明らかにする手法である。高い分解能を有するため、タンパク質の詳細な構造情報を得ることが可能であるが、試料の結晶化自体が技術的に難しい場合がある。↑
注8 イソペプチド結合
アミノ酸の側鎖のアミノ基やカルボキシル基が他のアミノ酸と形成するアミド結合。RES-701ではアスパラギン酸の側鎖のカルボキシル基がグリシンのアミノ基と結合している。↑
注9 芳香族アミノ酸残基
芳香族アミノ酸残基とは、ベンゼン環やその類似環を含むアミノ酸のことである。これらの残基は側鎖が大きく、タンパク質の立体構造の安定性向上や分子間相互作用に寄与する。↑
注10 疎水性相互作用
疎水的な側鎖を持つアミノ酸が形成する、非極性の相互作用。例えばロイシンやイソロイシンといったアミノ酸は側鎖が非極性であるため、極性を持つ水とは反発する一方で、同じく疎水的なアミノ酸と疎水性相互作用を形成する。↑


