DATE2025.04.01 #Press Releases
免疫応答に関与するCXCR3およびCXCR7のリガンド認識と下流シグナル選択機構を解明
発表のポイント
- 免疫応答を担う膜受容体CXCR3の立体構造を、リガンド非結合状態および特定の下流シグナルを偏向的に活性化する2種類の作動薬結合状態で解明しました。
- 培養細胞を用いた機能解析とリン酸化プロテオーム解析を組み合わせ、CXCR3およびCXCR7の下流シグナルを包括的に調査しました。
- 本研究は脊椎動物の免疫システムに対する理解を深め、がん・自己免疫疾患・アレルギー治療などへの応用が期待されます。
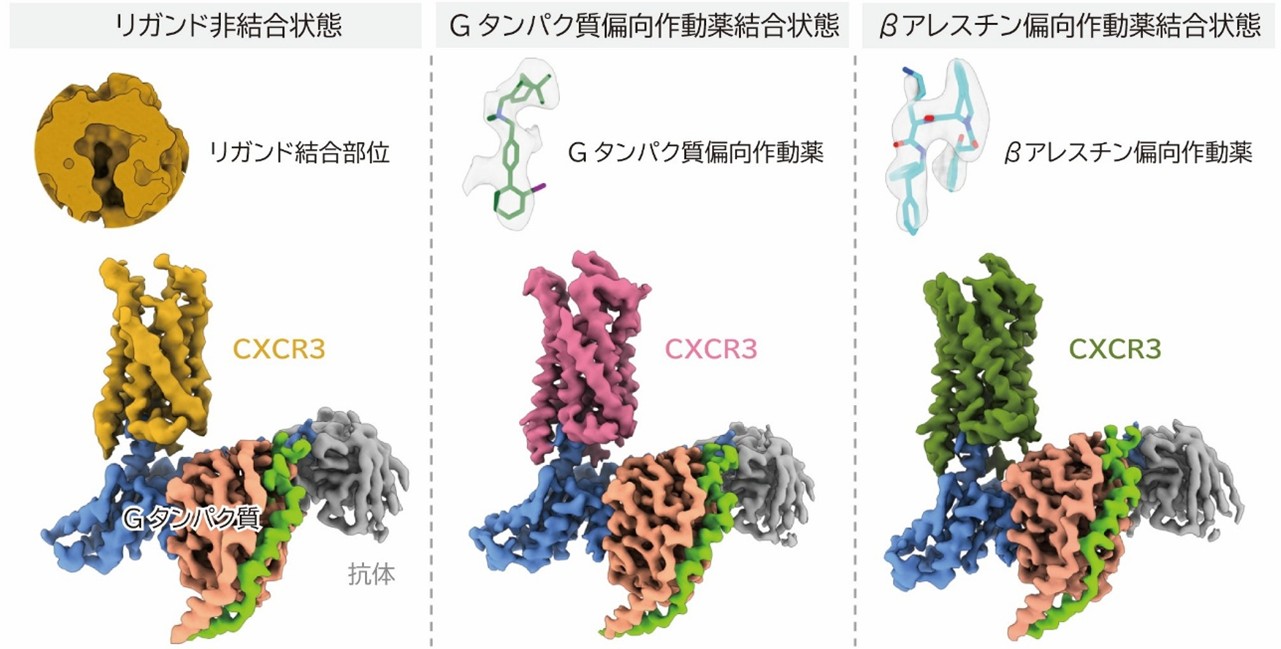
リガンド非結合状態および作動薬と結合した受容体CXCR3の立体構造
発表概要
東京大学大学院理学系研究科の佐野 文哉 博士課程学生、志甫谷 渉 助教、濡木 理 教授、インド工科大学のShirsha Saha博士課程学生、Arun K. Shukla教授らによる研究グループは、免疫応答を担う膜受容体CXCR3がリガンド(注1) を認識し、2つの異なる下流シグナルを偏向的に活性化する仕組みを、立体構造に基づいて解明しました。さらに、CXCR3と共通のリガンドによって活性化される別の受容体であるCXCR7の下流シグナルについて包括的に調査しました。
発表内容
ケモカイン(注2) は、炎症を起こした組織などから分泌される小さな球状タンパク質であり、シグナル分子として働きます。分泌されたケモカインは、免疫細胞に発現しているケモカイン受容体(注3) によって認識され、その遊走(注4) を引き起こします。このようにしてケモカイン受容体からなるシステムは炎症応答や感染防御、傷ついた組織の修復などにおいて重要な役割を担っています。ケモカイン受容体の中でも、CXCR3とCXCR7はユニークな特性を持ちます。これらの受容体はリガンドとして共通のケモカインを認識しますが、CXCR3は結合するケモカインによってGタンパク質(注5) シグナル とβアレスチン(注5) シグナル という異なる下流シグナルを活性化する一方、CXCR7はいずれのケモカインが結合してもβアレスチンシグナルのみを活性化します(図1)。しかし、各受容体がこのような特性を持つ背景にある機構については、これまでほとんど解明されていませんでした。

図1:CXCR3とCXCR7によるシグナル伝達
CXCR3とCXCR7はケモカイン(CXCLs)を認識すると、細胞内へシグナルを伝達します。2つの受容体はCXCL11という共通のリガンドを持ちます。
本研究ではまず、リガンド非結合状態および2つの下流シグナルを偏向的に活性化する2種類の低分子化合物が結合した状態のCXCR3の立体構造を、クライオ電子顕微鏡(注7) を用いて決定しました。得られた構造から、2つのリガンドは、かさ高い大きなアミノ酸残基によって構成されるCXCR3のポケットに異なる結合様式で結合することが明らかになりました(図2)。結合様式の違いにより、CXCR3は異なる構造変化を起こし、その結果として異なる下流シグナルを活性化すると考えられます。

図2:CXCR3における2種類の作動薬の結合様式
さらに本研究では、CXCR3とCXCR7が共通のケモカインを認識することにも着目し、内在性リガンドであるケモカインと同様に、2つの低分子化合物がCXCR7によって認識されることを新たに見出しました。これを手掛かりとして、詳細なシグナル伝達経路が不明であったCXCR7を対象にリン酸化プロテオーム解析(注8) を行い、潜在的なシグナル伝達経路を明らかにしました。
本研究の成果は、ケモカインシステムに特徴的なリガンドと受容体のクロストーク(注9) の分子機構を解明し、免疫系の理解を大きく深めるとともに、この種の受容体に広く見られる下流シグナル選択機構に関する普遍的な知見を提供するものです。これにより、ケモカイン受容体を標的としたがん、自己免疫疾患、アレルギーなどの治療薬の設計が促進されることが期待されます。
論文情報
-
雑誌名 Nature Communications 論文タイトル Molecular insights into dual-agonism and biased-signaling at the C-X-C type chemokine receptors CXCR3 and CXCR7著者 Shirsha Saha#, Fumiya K. Sano#, Parishmita Sarma#, Saloni Sharma#, Manisankar Ganguly, Annu Dalal, Sudha Mishra, Divyanshu Tiwari, Hiroaki Akasaka, Takaaki A. Kobayashi, Nabarun Roy, Nashrah Zaidi, Yuzuru Itoh, Rob Leurs, Gagan Deep Jhingan, Ramanuj Banerjee*, Wataru Shihoya*, Osamu Nureki* and Arun K. Shukla*
(# 共同第一著者, * 責任著者)DOI番号 s41467-025-58264-w
研究助成
本研究は、日本学術振興会(JSPS)「生体環境でのGPCRの構造ダイナミクス」(課題番号:21H05037 研究代表者:濡木 理)、「クライオ電子顕微鏡法を用いたGPCR創薬研究」(課題番号:22H02751 研究代表者:志甫谷 渉)、日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤ラットフォーム(BINDS)」などの支援により実施されました。
用語解説
注1 リガンド
生体内で特定の受容体や酵素に結合し、生理的な応答を引き起こす分子。ホルモン、神経伝達物質、サイトカイン、成長因子などが含まれ、標的タンパク質と特異的に相互作用することで、細胞内シグナル伝達や代謝調節を担う。↑
注2 ケモカイン
免疫細胞の移動を調節し、炎症応答や組織の修復に関与するタンパク質。感染防御や免疫応答の活性化において重要な役割を担う。↑
注3 ケモカイン受容体
ケモカインを認識する膜タンパク質であり、細胞内にシグナルを伝達することで細胞の遊走を制御する。免疫応答の調節に加え、炎症性疾患やがんの進展にも関与する。↑
注4 遊走
細胞が外部からのシグナルに応答して移動する現象。発生、組織修復、免疫応答などに重要な役割を果たし、細胞骨格の再構築や接着分子の調節によって制御される。異常な遊走はがんの転移や炎症疾患に関与する。↑
注5 Gタンパク質
細胞膜に存在する受容体と連携し、細胞内へシグナルを伝達するタンパク質。GTPとGDPの交換によって活性化・不活性化が制御される。これにより酵素やイオンチャネルなどを調節し、多様な細胞応答を引き起こす。↑
注6 βアレスチン
細胞膜に存在する受容体のシグナル調節や内部化を担うタンパク質。受容体の活性を制御するとともに、MAPキナーゼ経路などを活性化し、細胞の応答や機能に影響を与える。↑
注7 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸をはじめとする生体高分子の像を多数撮影することで立体構造の決定を行う単粒子解析法などに用いられる。↑
注8 リン酸化プロテオーム解析
細胞内のタンパク質のリン酸化修飾を網羅的に解析する手法。主に質量分析を用いて、シグナル伝達や細胞応答に関与するリン酸化部位を特定し、その動態を解析する。がんや神経疾患などの研究や創薬において重要な技術。↑
注9 クロストーク
異なる細胞内シグナル伝達経路が相互に影響を与える現象。一つのシグナルが別の経路を活性化または抑制することで、細胞応答の多様性や適応性を高める。発生や免疫応答、疾患の進行に関与し、シグナルのネットワーク解析が重要視されている。↑


