DATE2022.09.16 #プレスリリース
単独で停滞したリボソームのセンサー因子Fap1の同定
― 機能欠損リボソームを異常として認識・排除する仕組み ―
東京大学医科学研究所
東京大学大学院理学系研究科
概要
リボソームは、mRNA上の遺伝暗号を解読しタンパク質を合成する翻訳活動を担います。翻訳中のリボソームの停滞はタンパク質合成の異常を示す危険信号であり、翻訳品質管理機構により認識・解消されます。多くの品質管理機構がリボソーム間の衝突を停滞の目印とする一方、衝突を伴わない単独で停滞したリボソームを対象とする停滞解消の仕組みは不明でした。
今回、東京大学 医科学研究所RNA制御学分野/大学院理学系研究科生物科学専攻の稲田利文教授と東北大学大学院薬学研究科の李思涵大学院生、ミュンヘン大学Gene CenterのRoland Beckmann教授らのグループは、単独のリボソームに特化した停滞センサー因子として出芽酵母のFap1を世界で初めて同定しました。Fap1が単独で停滞した機能欠損リボソームに目印をつけ、停滞の解消と共にリボソーム自身の分解を誘導することを明らかにしました。
リボソームプロファイリング法によるmRNA上のリボソーム結合領域の網羅的解析およびクライオ電子顕微鏡を用いた構造解析より、Fap1はmRNA上に単独に存在するリボソームを好んで結合し、両側のmRNAの動きの停止を感知することを見出しました。本成果は、単独のリボソームによる翻訳が盛んな神経細胞等におけるリボソームの機能異常と疾患発症との関連の更なる理解につながると期待されます。
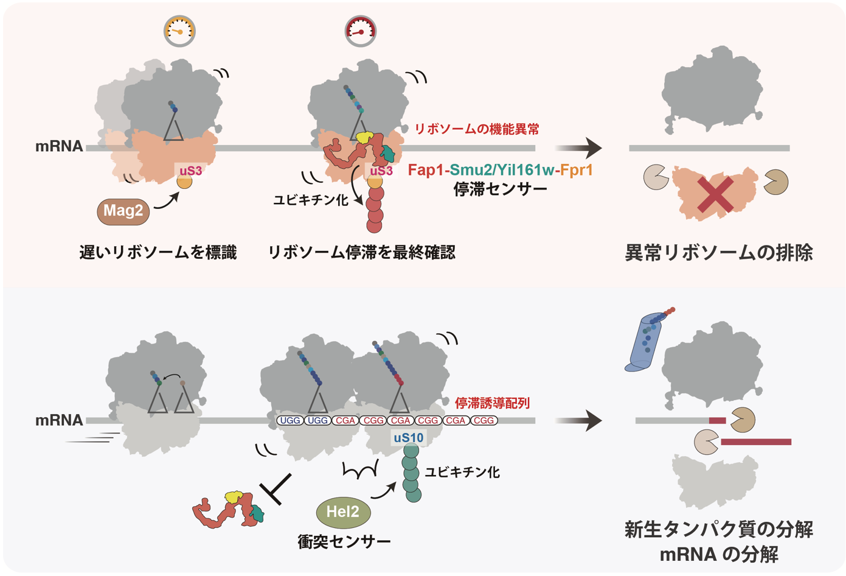
図:単独のリボソーム停滞とリボソーム衝突との比較
単独で停滞したリボソームが分解へと導かれる経路の模式図(上図)。Mag2が翻訳速度の遅いリボソームのuS3に一つ目のユビキチンを付加後、リボソームが単独で停滞した場合、停滞センサー因子Fap1が結合しユビキチン鎖を伸長させる。uS3に付加されたユビキチン鎖がリボソームの機能異常の目印と見なされ、リボソーム自身の分解・排除を引き起こす。一方、停滞したリボソームに後続のリボソームが衝突した場合(下図)、Fap1の結合が妨害され、衝突センサー因子Hel2によるuS10のユビキチン化およびそれに依存した品質管理が活性化する。
本研究は、CREST(課題番号:JP 19gm1110010、研究代表者:稲田利文)、日本学術振興会科学研究費助成事業(課題番号:JP18H03977, JP19H05281、稲田利文;21H00267, 21H05710, 22H02606、松尾芳隆)、科学技術振興機構(JST)さきがけ(課題番号:JPMJPR21EE、研究代表者:松尾芳隆)、日本学術振興会特別研究員奨励費(課題番号:20J20445、李思涵)、海外特別研究員(池内健)などの支援を受けて行われました。
本研究成果は、米国科学誌「Molecular Cell」(9月15日付けオンライン版)に公表されました。
詳細については、東京大学医科学研究所 のホームページをご覧ください。


