DATE2022.09.20 #プレスリリース
がんや肺炎にかかわるLPA受容体の活性型構造の解明
―新規化合物との相互作用を明らかにし、創薬研究に貢献―
赤坂 浩明(生物科学専攻 修士課程)
志甫谷 渉(生物科学専攻 助教)
濡木 理(生物科学専攻 教授)
発表のポイント
- 新規作動薬が結合したLPA受容体(LPA1)とGiタンパク質三量体との複合体の構造解析に成功しました。
- 作動薬の結合様式と活性化機構を明らかにし、生体内で働くLPAと作動薬の違いを示しました。また、受容体-タンパク質界面の構造多型を観測し、受容体の解離過程を表している可能性を提示しました。
- 本研究は、LPA1を標的としたより効果的で安全な作動薬の設計への道を拓くものです。
発表概要
リゾホスファチジン酸(LPA)(注1)は生体内において、細胞間の情報伝達分子として機能する脂質分子の一つです。LPAを受容するLPA受容体は6種類知られており、LPA受容体のすべてがGタンパク質共役型受容体(GPCR)(注2)と呼ばれるタイプの膜タンパク質です。そのなかでもLPA1は肺組織の線維化との関連性が知られており、がんをはじめとするさまざまな疾患の治療薬ターゲットとして注目されています。しかし、今まで報告されたLPA1の構造は拮抗薬と結合した不活性型のみであり、作動薬による詳細な活性化機構は不明でした。
今回、東京大学大学院理学系研究科の赤坂浩明大学院生、志甫谷渉助教、濡木理教授らのグループは、LPA1を活性化させる新規の作動薬を用い、クライオ電子顕微鏡(注3)によって、活性化したLPA1とGiタンパク質三量体(注4)との複合体の立体構造を決定しました。この構造をもとに作動薬が受容体をどのようにして活性型構造へと変化させるのか、その活性化の機序を明らかにしました。また、LPA1-Gタンパク質界面の構造多型を観測し、この構造多型がGタンパク質の解離過程を表している可能性を示しました。本研究の成果から、より効果的で安全な作動薬の設計が可能となり、創薬研究への貢献が期待されます。
本研究成果は、日本時間2022年9月15日に英国科学雑誌Nature communicationsにて公開されました。
発表内容
研究の背景
Gタンパク質共役型受容体(GPCR)は膜上に存在し、アゴニスト(作動薬)と結合すると活性型構造へと変化します。そして細胞内の三量体Gタンパク質と結合し、三量体Gタンパク質を活性化させることで細胞内へとシグナルを伝達します。GPCRのなかでもリゾホスファチジン酸(LPA)と呼ばれる分子を特異的に受容するLPA受容体は6種類が同定されています。そのなかの一つであるLPA1は神経細胞の遊走や分化、組織の線維化との関連性が知られており、その拮抗薬は、がんをはじめとするさまざまな疾患の治療薬ターゲットとして注目されています。また、作動薬に肥満や尿漏れの抑制効果があるという報告もあり、その作動薬の開発も行われています。LPAは生体内では分解されやすいため、LPA受容体の臨床応用や治療効果の探索に向けて、LPAに代わる強力かつ代謝安定性の高い作動薬の開発が期待されています。しかし、今まで報告されたLPA1の構造は拮抗薬と結合した不活性型のみであり、作動薬による詳細な活性化機構は明らかになっていませんでした。
研究の内容と成果
本研究では、クライオ電子顕微鏡によって、新規の作動薬によって活性化したLPA1とGiタンパク質三量体との複合体の立体構造を決定しました(図1)。本研究に用いた作動薬はLPAに類似していながらも、LPA1に対する50%効果濃度(EC50)が約1/30と低く、LPA1をより強力に活性化させます。
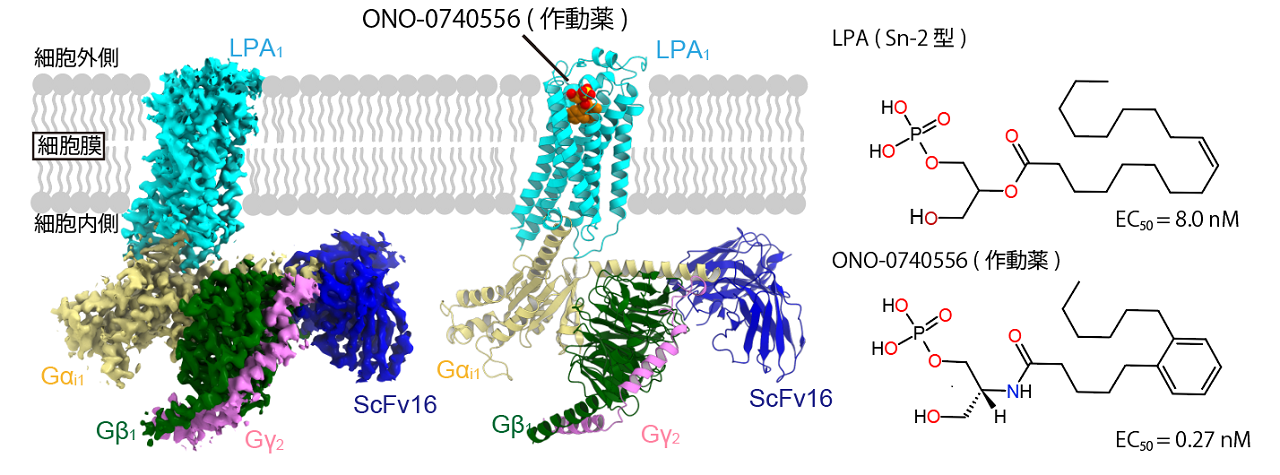
図1:LPAと作動薬の化学式、およびLPA1複合体の構造
不活性型の構造との比較から、作動薬の結合によって7番目の膜貫通ヘリックス(TM7)が動いていること、そして、結合領域底部の残基に働きかけてその配置を変化させていることが明らかになりました。これらの動きがスイッチとなり、受容体全体が活性型構造へと変化し、Gタンパク質との結合が可能となります(図2)。

図2:作動薬によるLPA1の活性化
不活性型の構造(Chrencik et al., 2015)と重ね合わせた図。作動薬の結合によって結合領域の構造が変化している(左、中央)。活性型構造へと変化したLPA1は膜貫通ヘリックス6(TM6)が外側に大きく動き、Gタンパク質との結合が可能となる(右)。
また、本論文の投稿中に公開されたLPAが結合したLPA1の構造モデルと比較することで、作動薬がなぜLPAと比べて親和性が高いのかを明らかにしました。LPAと新規作動薬とでは、リン酸基頭部の認識機構はほとんど同じであった一方、結合領域内部では炭化水素鎖の折れ曲がる位置が異なっています。これにより疎水性残基との相互作用が変化し、LPA1に対する親和性の違いを引き起こしています(図3)。このような情報は今後のLPA1を標的とした化合物の設計において有用な手掛かりとなり、創薬研究への貢献が期待されます。

図3:LPA結合型構造との比較
LPA結合型の構造(S. Liu et al., 2022)と重ね合わせた図。結合領域を細胞外側から見た図(左)と側面から見た図(右)。LPAはTM5付近で折れ曲がっているのに対し、ONO-0740556はTM7付近で折れ曲がっている。
また本研究では、LPA1-Gタンパク質界面において、結合状態の異なる構造を決定しました。その中にはLPA1とGiとの距離が離れている構造もあり、この結合状態の違いがGタンパク質の解離過程を表している可能性を示しました(図4)。これにより今後のGPCR-Gタンパク質複合体の研究が進展していくことが期待されます。

図4:Giの解離過程
最安定な構造と構造多型(状態1、2)を重ね合わせた図。状態1から2へとGiがLPA1から離れる方向へと変化している。
本研究は、日本学術振興会における科学研究費助成事業の基盤S「生体環境でのGPCRの構造ダイナミクス」(課題番号:21H05037 研究開発代表者:濡木 理)や基盤B「クライオ電子顕微鏡法を用いたGPCR創薬研究」(課題番号:22H02751 研究開発代表者:志甫谷 渉)、小野医学研究財団 研究奨励助成 「リゾフォスファチジン酸受容体LPA1の構造解析とNAMの開発」(研究開発代表者:志甫谷 渉)などの一環で行われました。また、本研究は、AMED「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
発表雑誌
-
雑誌名 Nature communications 論文タイトル Structure of the active Gi-coupled human Lysophosphatidic Acid Receptor 1 complexed with a potent agonist 著者 Hiroaki Akasaka, Tatsuki Tanaka, Fumiya K. Sano, Yuma Matsuzaki, Wataru Shihoya*, Osamu Nureki* DOI番号
用語解説
注1 リゾホスファチジン酸(LPA)
リゾホスファチジン酸(LPA)は生体内において細胞間の情報伝達分子として機能する脂質分子です。生体内ではリン脂質から産生され、リン酸基を含む負電荷を帯びた頭部と疎水的な炭化水素鎖により構成されています。6種のLPA受容体(LPA1—LPA6)が同定されており、LPA分子はこれらの受容体を介し細胞の増殖や細胞の移動などさまざまな細胞応答を引き起こします。↑
注2 Gタンパク質共役型受容体(GPCR)
GPCRは細胞膜に発現する膜タンパク質で、膜を貫通する7本のαヘリックスで構成されています。膜受容体タンパク質のなかで最大のファミリーを形成し、細胞外領域で特定のリガンドが結合することで活性化し、細胞内のGタンパク質三量体を活性化することでシグナルを伝達します。体内で多様な生理作用の調節に重要な役割を果たすことから、既承認薬の30%以上がGPCRを標的にした薬剤になっています。↑
注3 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置です。タンパク質や核酸をはじめとする生体高分子の像を多数撮影することで立体構造の決定を行う、単粒子解析法に用いられます。↑
注4 Gタンパク質、Giタンパク質三量体
Gタンパク質は、細胞内情報伝達に関わるGTP結合タンパク質であり、Gα、Gβ、Gγサブユニットの三量体により構成されます。活性化されたGタンパク質共役型受容体(GPCR)と結合したGタンパク質三量体では、GDP-GTP交換反応が起き、GαとGβ-Gγの二つに解離します。解離したサブユニットが下流のシグナル伝達因子と結合し活性化することで、細胞にさまざまなシグナル応答が生じます。Gαサブユニットは大きくGs、Gi、Gq/11、G12/13の4種類に分別され、特にGiタンパク質三量体は、下流でアデニル酸シクラーゼの活性を阻害することで、抑制性のシグナルを伝達します。↑


