DATE2023.09.30 #Press Releases
改変した『ゲノム編集のための最小のはさみ』
大村 紗登士(生物科学専攻 修士課程)
中川 綾哉(生物科学専攻 博士課程)
濡木 理(生物科学専攻 教授)
日野 智博(京都府立医科大学 後期専攻医)
星野 温(京都府立医科大学 講師)
的場 聖明(京都府立医科大学 教授)
冨樫 朋貴(自治医科大学/本所属:金沢大学大学 博士課程)
大森 司(自治医科大学 教授)
発表のポイント
- CRISPR-Cas12酵素の中で最小のAsCas12fの立体構造を決定した。
- Deep mutational scanning(DMS)というスクリーニング手法をCRISPR-Cas酵素に世界で初めて適用した。
- DMSと構造情報に基づく合理的な改変によって、ゲノム編集活性を高めた改変型AsCas12fの作製に成功した。
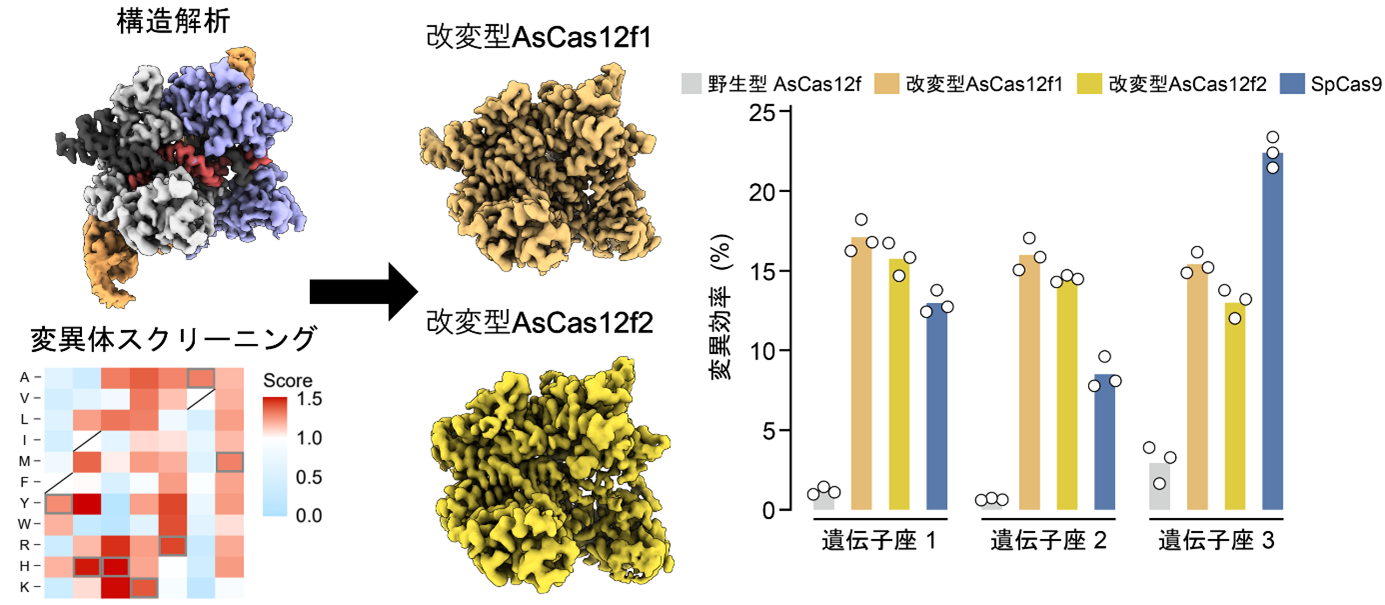
構造解析とDMSによるAsCas12fの改変
発表概要
東京大学大学院理学系研究科生物科学専攻の大村紗登士大学院生、中川綾哉大学院生、濡木理教授らは、クライオ電子顕微鏡(注1)を用いて、V型CRISPR-Cas酵素(注2)として最小の大きさのAsCas12fの立体構造を決定しました。また、京都府立医科大学の日野智博後期専攻医、星野温講師、的場聖明教授、自治医科大学の冨樫朋貴大学院生、大森司教授らと共同で、Deep mutational scanning(DMS)(注3)を用いた変異体スクリーニングと得られた構造情報に基づいた合理的なAsCas12fの改変を行い、野生型と比べてはるかにゲノム編集活性の高い改変型AsCas12fを作製しました。
発表内容
〈研究の背景〉
原核生物のCRISPR-Cas獲得免疫機構に関与するII型CRISPR-Cas酵素のCas9は、ガイドRNAと複合体を形成し、ガイドRNAのガイド配列と相補的な二本鎖DNAを切断する「はさみ」として機能することで、ファージなどの外来核酸に対する防御を担っています。ガイド配列は任意の配列に設計することができるため、Cas9は生命の設計図であるゲノム情報を人為的に書き換えるゲノム編集技術として、遺伝子治療や創薬、遺伝子改変生物を用いた基礎研究などにおいて広く利用されています。Cas9を遺伝子治療に利用する場合、Cas9は分子のサイズが大きいため(1368アミノ酸残基)、細胞への導入効率が悪いという問題点が残されています。
一方、最小のV型CRISPR-Cas酵素として近年発見されたAcidibacillus sulfuroxidans由来のCas12f(AsCas12f)は、Cas9の1/3以下の422アミノ酸残基で機能することから、細胞への導入効率の高い、新規の小型ゲノム編集ツールとして期待されています。
〈研究の内容〉
今回、東京大学の濡木理教授らのグループは、クライオ電子顕微鏡を用いて、AsCas12f-ガイドRNA-標的二本鎖DNA複合体の立体構造を決定することに成功しました(図1)。得られた立体構造から、ガイドRNAが塩基配列からは予測できない複雑な立体構造をとっており、一分子のガイドRNA上で二分子のAsCas12fが二量体を形成していることが分かりました(図1)。
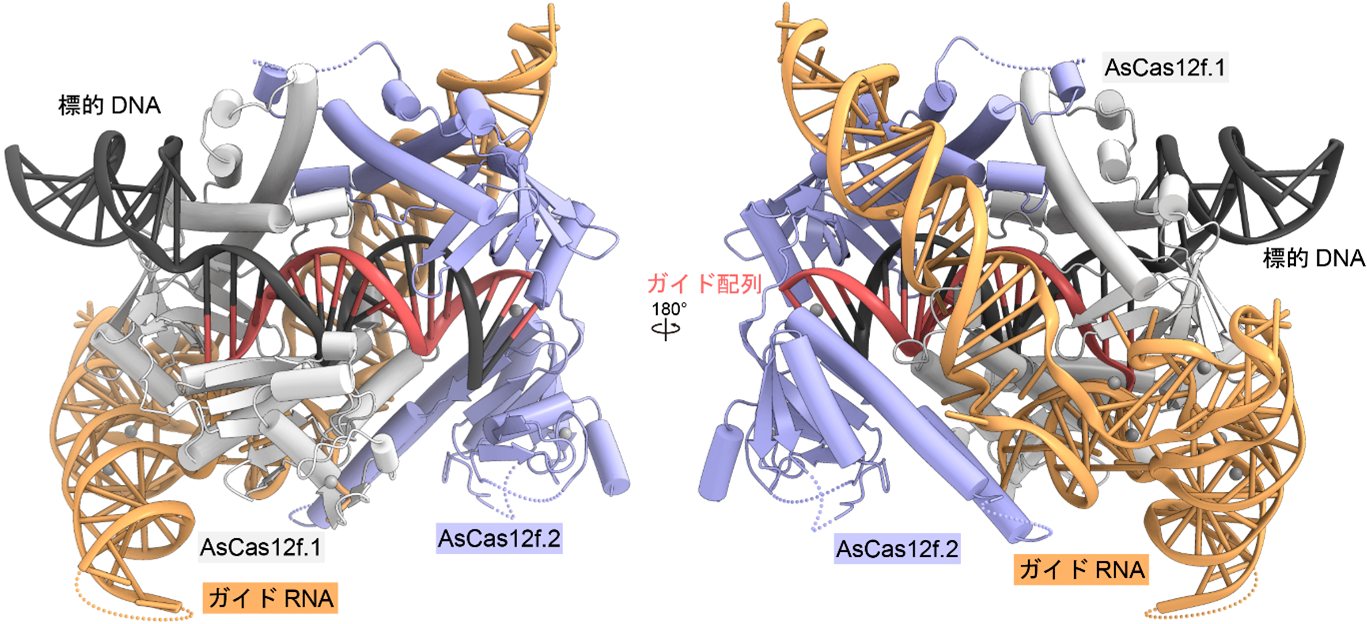
図1:AsCas12f-ガイドRNA-標的DNA複合体の立体構造
また、京都府立医科大学の星野温講師、的場聖明教授、自治医科大学の大森司教授らのグループとの共同研究により、Deep mutational scanning(DMS)による変異体スクリーニングと構造情報に基づくガイドRNAの改変を行い、Cas9と匹敵する高いゲノム編集活性を有する2種類のAsCas12f改変体(AsCas12f-YHAM、AsCas12f-HKRA)を開発しました(図2)。
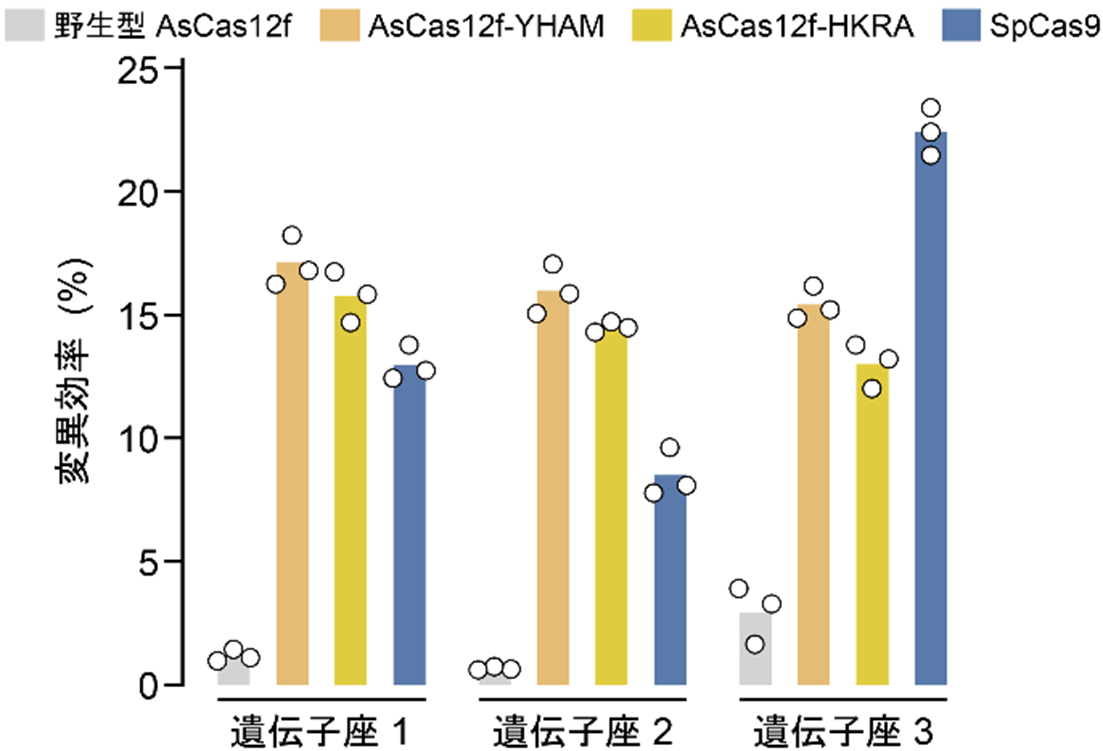
図2:ヒト培養細胞におけるDNA切断活性
今回開発された2種類のAsCas12f改変体は、搭載可能な遺伝子の大きさに制限のあるウイルスベクター(注4)に余裕をもって搭載可能であるため、ウイルスベクターを利用した遺伝子治療のための革新的なゲノム編集ツールとなることが期待されます。
論文情報
-
雑誌名 Cell 論文タイトル An AsCas12f-based compact genome editing tool derived by deep mutational scanning and structural analysis著者 Tomohiro Hino*, Satoshi N. Omura*, Ryoya Nakagawa*, Tomoki Togashi*, Satoru N. Takeda, Takafumi Hiramoto, Satoshi Tasaka, Hisato Hirano, Takeshi Tokuyama, Hideki Uosaki, Soh Ishiguro, Madina Kagieva, Hiroyuki Yamano, Yuki Ozaki, Daisuke Motooka, Hideto Mori, Yuhei Kirita, Yoshiaki Kise, Yuzuru Itoh, Satoaki Matoba, Hiroyuki Aburatani, Nozomu Yachie, Tautvydas Karvelis, Virginijus Siksnys, Tsukasa Ohmori**, Atsushi Hoshino**, and Osamu Nureki** (*筆頭著者、**責任著者)DOI
研究助成
本研究は、国立研究開発法人日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「安全な遺伝子治療を目指した万能塩基編集ツールの創出」(研究代表者:濡木 理)官民研究開発投資拡大プログラム(PRISM)「ゲノム編集酵素の機能モジュールデータ基盤構築」(課題番号:JPJ008000 研究分担者:濡木 理)、AMED「創薬等ライフサイエンス研究支援基盤事業」の一環とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」、AMED「ワクチン開発のための世界トップレベル研究開発拠点の形成事業」の一環とした「ワクチン開発のための世界トップレベル研究開発拠点群東京フラッグシップキャンパス」、AMED「エイズ対策実用化研究事業」(課題番号:JP22fk0410037研究代表者:大森 司)、AMED「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業」(課題番号:JP22ae0201007研究分担者:大森 司)、公益財団法人日本応用酵素協会などの支援により行われました。
用語解説
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸の立体構造の決定に利用されている。↑
原核生物のもつCRISPR-Cas獲得免疫システムにおいて外来核酸の分解を担う酵素。CRISPR-Cas酵素は6つのタイプ(I–VI型)に分類される。II型CRISPR-Cas酵素Cas9やV型CRISPR-Cas酵素Cas12はガイドRNAと複合体を形成し、ガイドRNAと相補的な2本鎖DNAを特異的に切断する。↑
注3 Deep mutational scanning(DMS)
培養細胞系を用いた変異体スクリーニング手法。標的タンパク質の各アミノ酸残基をそれぞれ20種類のアミノ酸に変異させた際の活性変化を網羅的に調べることができる。 ↑
目的遺伝子を標的細胞に導入するために利用されるウイルス。アデノ随伴ウイルスなどのウイルスベクターを用いることにより、Cas酵素やgRNAを目的の組織に導入することができる。↑


