DATE2023.09.04 #Press Releases
がん細胞の細胞死との付き合い方
――ミトコンドリアに集まったテロメラーゼ逆転写酵素による細胞死制御の二面性――
江端 拓志(生物科学専攻 博士課程:研究当時)
島 知弘(生物科学専攻 助教)
飯塚 怜(生物科学専攻 助教)
上村 想太郎(生物科学専攻 教授)
発表のポイント
- がん細胞がどのように細胞死を制御しているのかの一端を解明しました。
- これまでの実験手法では実現できなかった、テロメラーゼ逆転写酵素(TERT)の細胞内における分布と細胞死過程を同時に可視化することに成功しました。
- 今回判明したがん細胞の細胞死制御様式を基にした、がん治療における副作用低減への貢献が期待されます。
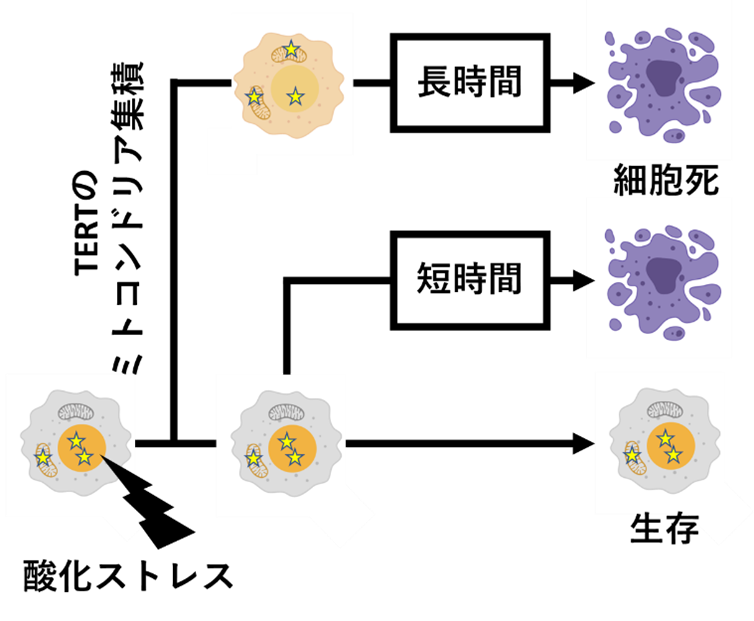
TERTのミトコンドリア集積による細胞死制御モデル
発表概要
東京大学大学院理学系研究科の江端拓志博士課程学生(当時)、島知弘助教、飯塚怜助教、上村想太郎教授による研究グループは、テロメラーゼ逆転写酵素(TERT注1)がミトコンドリア(注2)という細胞内区画に集積する様子と細胞が死ぬタイミングを同時に可視化することで、がん細胞がどのように細胞の死を制御しているかの一端を明らかにしました。これまで、TERTの集積と細胞死(注3)との関連は提唱されていましたが、直接的に検証するための実験基盤すらない状態でした。
本研究グループはTERTの機能を阻害しない可視化法を開発し、がん細胞が細胞死に至る過程におけるTERTの細胞内での分布を計測しました。その結果、TERTのミトコンドリアへの集積が、ゆっくりとした細胞死を誘発することが示唆されました。本成果は、これまであまり研究の進んでいないミトコンドリアにおけるTERTの機能研究の基盤を構築しただけでなく、がん治療における新たな戦略の創出につながることが期待されます。
発表内容
〈研究の背景〉
がん細胞は増殖能の高さに加え、細胞死への高い耐性を有することから、がん細胞を除去するためには強力ながん治療を行う必要があります。こうした強力ながん治療はしばしば、がん組織周辺の正常な細胞にもダメージを与え、深刻な副作用を引き起こしてしまいます。そのため、がん細胞がどのように細胞死を制御しているのかを解明することはがん治療の効果を上げる上で大変重要です。
ほとんどのがん細胞はTERTと呼ばれるタンパク質を豊富に含み、TERTの細胞核(注4)内での働きによって、無限に増殖することが可能となっています。一方で、成人の体を構成している正常な細胞のほとんどはTERTを含んでおらず、がん細胞との大きな違いとして知られています。がん細胞において、TERTは細胞核だけでなく、ミトコンドリアと呼ばれる細胞内区画にも局在し、特に酸化ストレスを受けることでミトコンドリアへ集積することが知られていました。酸化ストレスは細胞死を誘導する刺激のひとつであることから、TERTのミトコンドリアでの機能ががん細胞の細胞死耐性に重要な役割を持つのではないか、と考えられてきました。しかし、酸化ストレスを受けてTERTをミトコンドリアに集積させた細胞が細胞死を引き起こすかどうかを直接検証した研究はこれまでになく、TERTのミトコンドリア局在と細胞死との関係はわかっていませんでした。
〈研究の内容〉
研究グループは、TERTに蛍光タンパク質(注5)を付加することで、顕微鏡下で細胞内でのTERTのミトコンドリアへの集積過程と細胞死を同時に可視化できると考えました。そこで、TERTの機能を阻害しない位置に蛍光タンパク質を付加しました。蛍光タンパク質を付加したTERTをがん細胞に導入し、酸化ストレス後の様子を顕微鏡で観察したところ(図1)、がん細胞には酸化ストレスを受けた後、すぐにTERTをミトコンドリアへ集積させるグループと、しばらくTERTをミトコンドリア外へ留めておくグループの、2つのグループがあることがわかりました。TERTをミトコンドリアへ集積させたグループでは酸化ストレス後72時間以内に全細胞が死亡した一方で、TERTをミトコンドリア外へ留めていたグループでは72時間後も生存している細胞が一部観察されました。興味深いことに、酸化ストレスを受けてから細胞死へと至る時間を計測したところ、TERTをミトコンドリアへ集積させたグループは、ミトコンドリア外へ留めていたグループよりも細胞死への時間が長くかかる傾向が認められました。
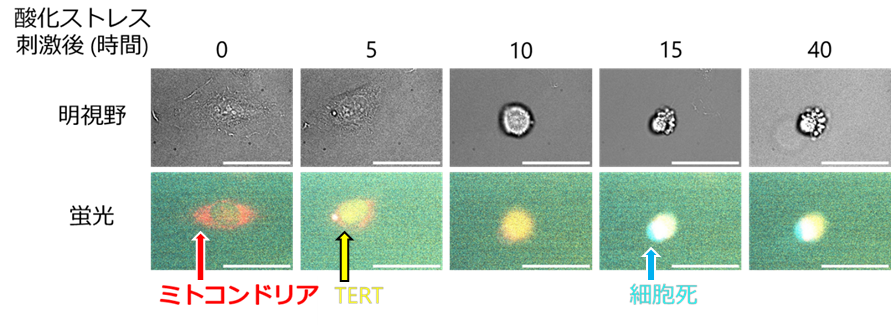
図1:TERTのミトコンドリア集積と細胞死の可視化
これらの観察結果を受け、本研究グループはTERTのミトコンドリア集積とがん細胞の細胞死との関係のモデルを考案しました(図2)。このモデルにおいて、酸化ストレスへの応答の初期段階ではTERTのミトコンドリアへの集積が細胞死を決定づける要因であり、TERTをミトコンドリア外へと留めていた場合細胞死へ至るのかは決定されません。その後、酸化ストレス応答の後期に至ると、TERTをミトコンドリアへと集積させていた細胞での細胞死には時間がかかる一方で、TERTをミトコンドリア外へ留めていたものの細胞死へと向かうこととなった細胞では迅速に細胞死が引き起こされます。
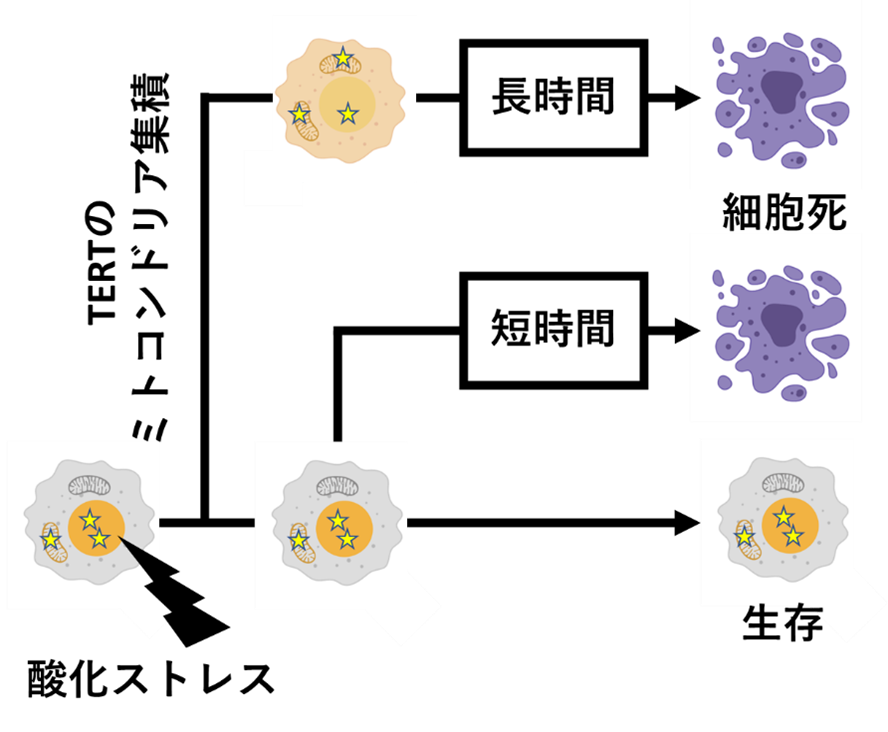
図2:TERTのミトコンドリア集積による細胞死制御モデル
〈今後の展望〉
研究グループの研究成果と考案したモデルは、がん細胞が死ぬ過程における制御機構全体を理解する上で重要な知見をもたらしました。また、がん細胞の細胞死制御の一端を解明した今回の研究成果は、TERTの細胞内での分布を新たながん治療の標的として利用することでがん治療効果向上への応用が期待されます。
論文情報
-
雑誌名 FEBS Open Bio 論文タイトル Accumulation of TERT in mitochondria exerts two opposing effects on apoptosis著者 Hiroshi Ebata, Tomohiro Shima, Ryo Iizuka, Sotaro UemuraDOI番号
研究助成
本研究は、科研費「特別研究員奨励費(課題番号:21J10299 研究代表者:江端拓志)」、科研費「基盤研究(C)(課題番号:18K06147 研究代表者:島知弘)」、「新学術領域研究(課題番号: 19H05379、21H00387 研究代表者:島知弘)」の支援により実施されました。
用語解説
テロメア領域と呼ばれるDNAの繰り返し配列を修復するタンパク質。略称TERT。本研究を含むさまざまな研究から、近年、テロメア領域の修復だけではなく多様な機能をもつことが明らかになってきています。↑
細胞内で細胞死の制御や、生命活動のエネルギーとして利用されるATPの合成を行う細胞内小器官。ミトコンドリアにはテロメア領域を含むDNAが存在しないことから、ミトコンドリアに集まるTERTはテロメア修復以外の、特に細胞死と関連した機能をもつと予想されてきました。↑
細胞のあらゆる生命現象が停止し、修復不可能な状態になること。遺伝子への傷害の程度が甚大であったり、強いストレス刺激を受けたりすると、細胞は自身を委縮・断片化させる「制御された細胞死」に至る仕組みを発動させます。↑
遺伝子情報を含む細胞内小器官。細胞核を有する細胞を真核細胞、有さない細胞を原核細胞と呼び、TERTの関わるテロメア領域は真核細胞のみに存在します。ミトコンドリアは原核生物に由来(真核細胞が原核生物を取り込んだ)という説があり、ミトコンドリアにテロメア領域が存在しないこともこの説を支持しています。↑
特定の色の光のエネルギーを吸収し、異なる色の光を発するタンパク質。本研究では蛍光タンパク質をTERTにつけたうえで、蛍光タンパク質の発した光からTERTの位置を特定しました。 ↑


