DATE2023.03.07 #Press Releases
異常翻訳の実体である衝突リボソームの解消機構
――mRNA引っ張り力によるリボソーム構造変化による異常翻訳解消機構――
東京大学医科学研究所
東京大学大学院理学系研究科
東京大学大学院新領域創成科学研究科
発表概要
東京大学 医科学研究所RNA制御学分野/大学院理学系研究科生物科学専攻/大学院新領域創成科学研究科メディカル情報生命専攻の稲田利文教授と東京大学 医科学研究所RNA制御学分野の松尾芳隆准教授、ミュンヘン大学Gene Centerの大学院生Katharina BestとRoland Beckmann教授のグループは、翻訳因子eIF5Aが非典型翻訳CATテイリング反応を促進することを世界で初めて解明しました。
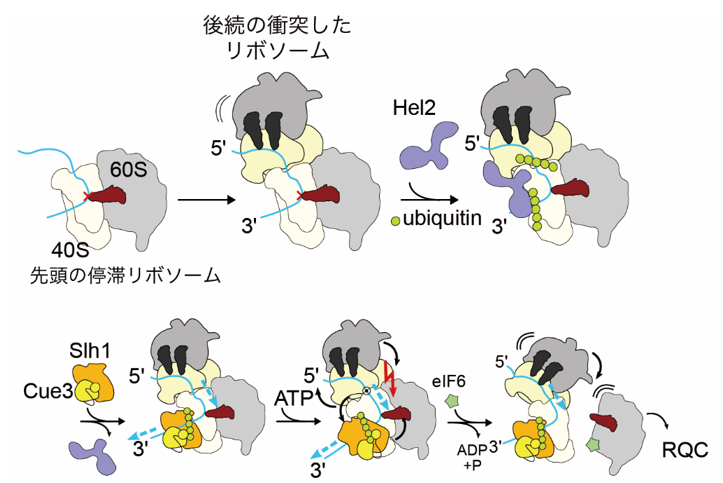
翻訳停滞によってリボソームの交通渋滞が蓄積すると、細胞死や炎症応答さまざまなストレス応答が誘導されます。一方で過剰なストレス応答を防ぐために、細胞はリボソームの交通渋滞を解消する品質管理機構を備えています。品質管理因子であるHel2はリボソームの衝突を識別し、異常翻訳の目印としてユビキチンを付加します。このユビキチン化が目印となり、RQT(Ribosome Quality control Trigger) 複合体が停滞リボソームを強制的にサブユニット解離させることで交通渋滞を解消します。研究グループでは、これまで生化学的手法を用いて衝突リボソームにK63型のユビキチン鎖が形成され、それをRQT複合体が識別し、ATP 加水分解依存に衝突リボソームを解消することを発見しました。一方で、ATP加水分解依存に、衝突リボソームを各サブユニトに解離させる分子機構は十分に理解されていませんでした。
今回研究グループでは、クライオ電子顕微鏡を用いて衝突リボソーム解消複合体(RQT複合体)と衝突リボソームの可視化に成功しました。その結果、RQT複合体がmRNAに引っ張り力を加え、リボソームの小さなサブユニットの構造変化を不安定化させ、最終的にサブユニットを解離させることを、世界で初めて明らかにしました。
本成果は、品質管理機構の破綻が原因とされる神経変性疾患などの発症機序の理解や新規治療戦略の開発につながることが期待されます。
本研究成果は2月17日、米国科学誌「Nature Communications」に掲載されました。
詳しくは、東京大学医科学研究所 のホームページをご覧ください。


