DATE2022.06.30 #Press Releases
Dicer-2–R2D2タンパク質複合体が二本鎖siRNAの非対称性を感知するしくみ
― RNA干渉における20年来の謎を解明 ―
山口 そのみ(生物科学専攻 博士課程3年)
泊 幸秀(定量生命科学研究所 教授)
西増 弘志(先端科学技術研究センター 教授)
濡木 理(生物科学専攻 教授)
発表のポイント
- ショウジョウバエ由来のDicer-2、パートナータンパク質R2D2、および、二本鎖siRNAから形成される複合体の立体構造を世界で初めて明らかにしました。
- Dicer-2–R2D2が二本鎖siRNAを決まった向きでArgonauteに受け渡す分子機構を明らかにしました。
- 本成果は、Dicerの作動機構の理解だけではなく、効率的な二本鎖siRNAの設計や核酸医薬等への技術応用が期待されます。
発表概要
20塩基ほどの小さなRNA(siRNA(注1) )はArgonauteタンパク質とエフェクター複合体を形成し、相補的な塩基配列をもつ標的遺伝子の発現を制御します。この遺伝子制御機構はRNA干渉とよばれ、ショウジョウバエなどの昆虫において免疫機構としてはたらきます。さらに、RNA干渉は遺伝子発現抑制技術としても広く利用されています。RNA切断酵素であるDicer-2は二本鎖siRNAの産生とArgonauteへの受け渡しを担っています。しかし、その詳細な分子機構は明らかになっていませんでした。
今回、東京大学大学院理学系研究科生物科学専攻の山口そのみ大学院生、濡木理教授、定量生命科学研究所RNA機能研究分野の泊幸秀教授、先端科学技術研究センターの西増弘志教授らは、クライオ電子顕微鏡(注2) を用いて、Dicer-2–R2D2二本鎖siRNA複合体の立体構造を決定することに成功しました。その結果、Dicer-2–R2D2による二本鎖siRNAの産生および受け渡しの分子機構が明らかになりました。本成果は、Dicerの作動機構の理解だけではなく、効率的な二本鎖siRNAの設計や核酸医薬(注3) 等への技術応用が期待されます。
発表内容
ショウジョウバエ由来Argonaute(Ago2)はsiRNAとRISC(RNA-induced silencing complex)とよばれるエフェクター複合体を形成し、ウイルスやトランスポゾン(注4)由来のRNAの発現を抑制します(図1)。RNA切断酵素であるDicer-2はパートナータンパク質であるR2D2と複合体を形成し、長い二本鎖RNAを切断することで二本鎖siRNAを産生します(図1)。二本鎖siRNAの末端は塩基配列の違いにより熱力学的な安定性が異なります。すなわち、ミスマッチ塩基やA-T塩基対を多く含む末端は熱力学的に不安定になります。泊教授らによる2004年の生化学的解析から、Dicer-2–R2D2は、長い二本鎖を切断するだけではなく、産生した二本鎖siRNAをいったん放出した後、その非対称性を感知して、熱力学的に不安定な末端がDicer-2、安定な末端がR2D2の近くになるように改めて結合しなおすということが明らかにされました(図1)。さらに、生化学的解析から、Ago2は二本鎖siRNAのうち、熱力学的に不安定な末端を含むRNA鎖をガイド鎖(注5) として選択することがわかっていました(図1)。
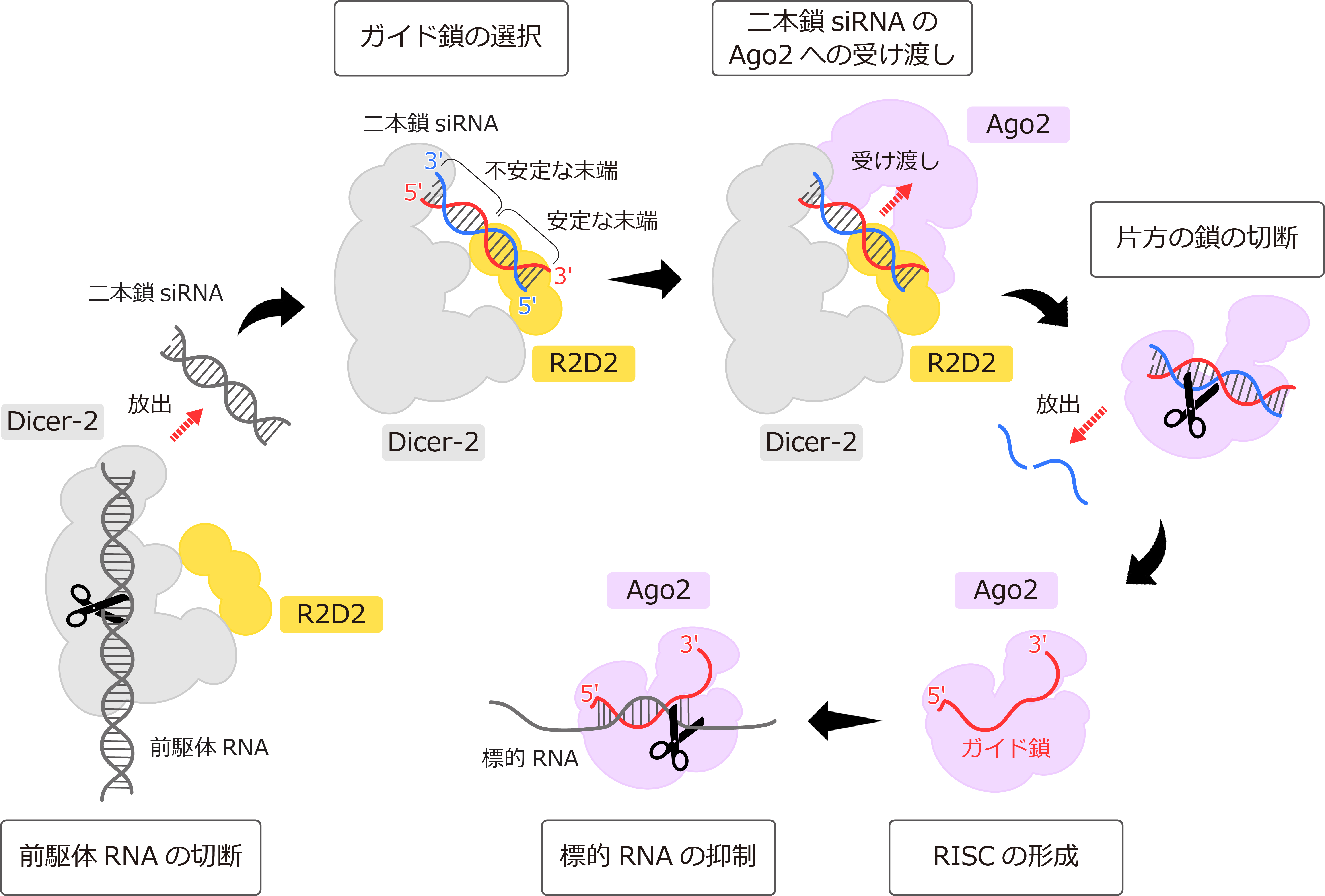
図1:RNA干渉におけるDicer-2–R2D2およびAgo2のはたらき
したがって、Dicer-2–R2D2は二本鎖siRNAの熱力学的な非対称性を感知し、二本鎖siRNAを決まった向きでAgo2に受け渡すことにより、二本鎖siRNAのどちらの鎖がガイド鎖として使われるかを決定していることが示唆されてきました。ガイド鎖の配列によって生体内で抑制される遺伝子が決定されるため、Dicer-2–R2D2によるAgo2への二本鎖siRNAの受け渡しは標的遺伝子の決定における重要なステップです。しかし、Dicer-2–R2D2の立体構造は不明であり、Dicer-2–R2D2が二本鎖siRNAの熱力学的な非対称性を感知し、二本鎖siRNAを決まった向きでAgo2に受け渡す分子機構はR2D2の発見以来、20年近く明らかになっていませんでした。
本研究では、クライオ電子顕微鏡を用いてDicer-2–R2D2タンパク質複合体に二本鎖siRNAが結合した状態の立体構造を3.3 Å分解能で決定しました。その結果、Dicer-2は主にヘリケースドメイン、Platform-PAZドメイン、RNase IIIドメイン、C末端RNA結合ドメイン(CRBD)から構成されており、ヘリケースドメインを介してR2D2と結合していることが明らかになりました。注目すべきことに、R2D2にはガイド鎖選択状態の二本鎖siRNAが結合していました(図2)。
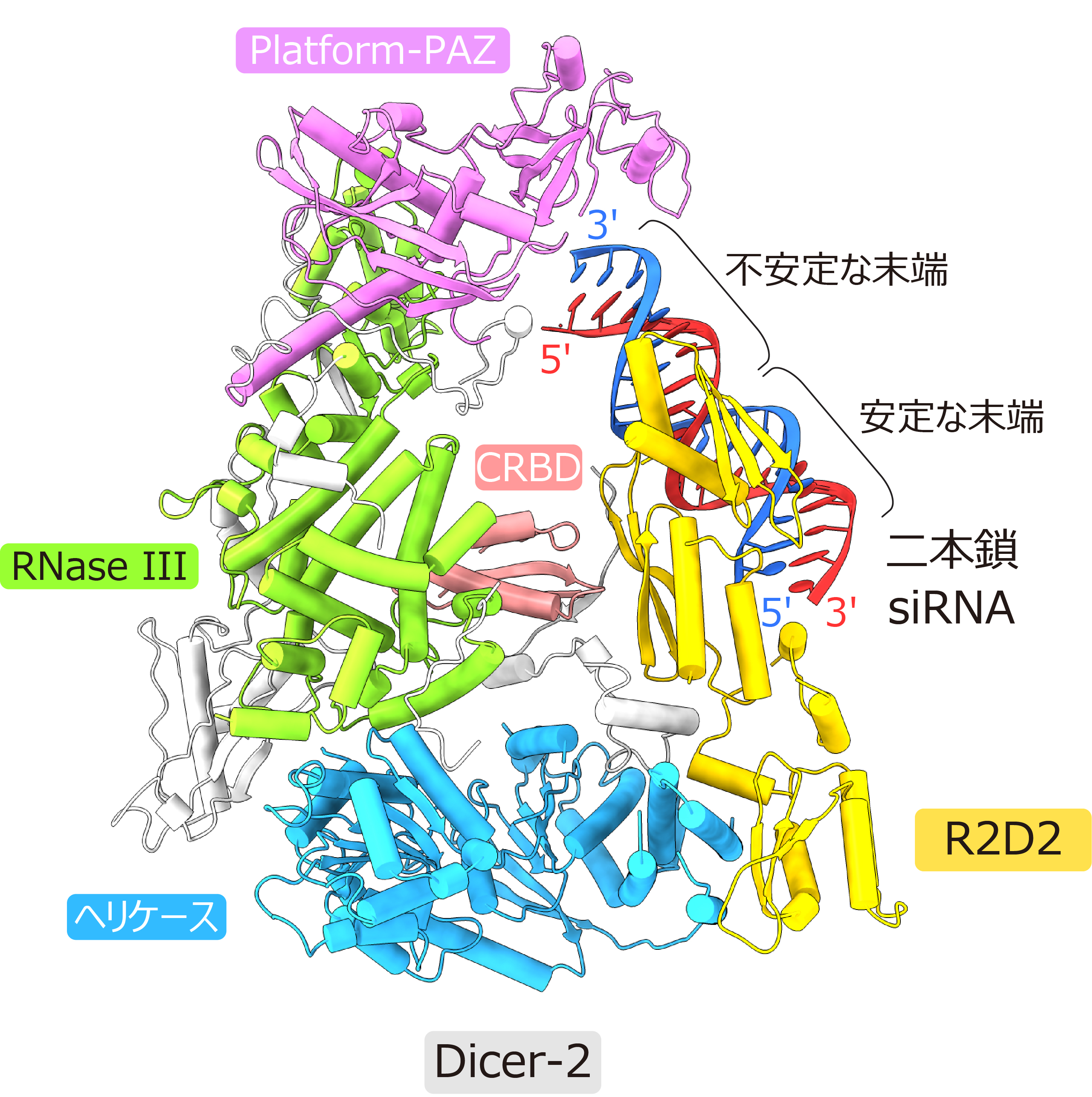
図2:Dicer-2–R2D2–二本鎖siRNA複合体のクライオ電子顕微鏡構造
二本鎖siRNAのうち熱力学的に不安定な末端は溶媒に露出している一方、安定な末端はR2D2に結合していました。生化学的解析から、R2D2はより二重らせん性の高い(すなわち熱力学的に安定な)末端に好んで結合することが明らかになりました。今回の構造にAgo2が結合したモデルを作製したところ、二本鎖siRNAの不安定な末端はAgo2との結合に適した位置に存在することが示唆されました(図3)。
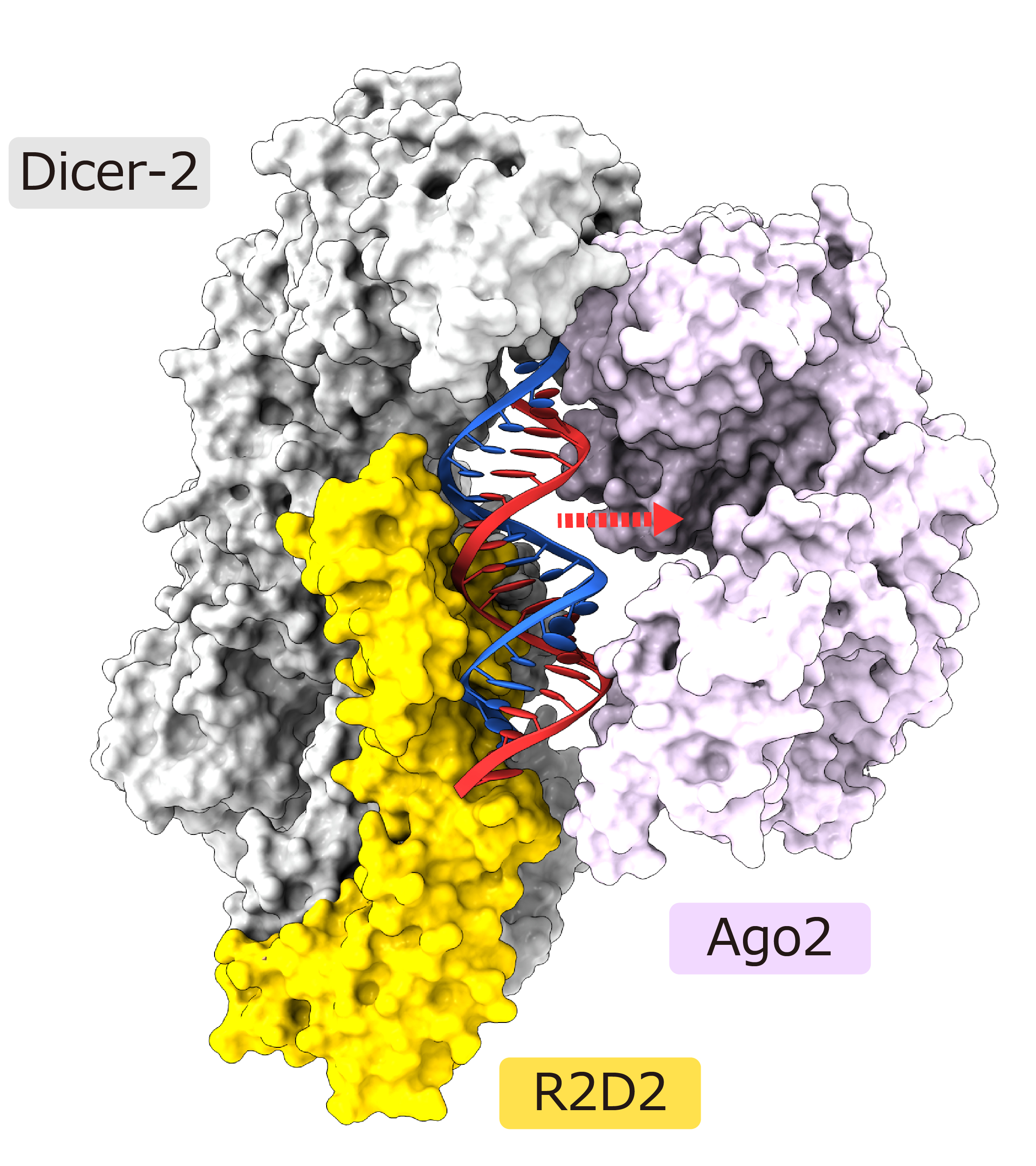
図3:Dicer-2–R2D2–二本鎖siRNA複合体にAgo2が結合した構造モデル
これらの結果から、Dicer-2–R2D2が二本鎖siRNAを決まった向きでAgo2に受け渡す分子機構が明らかになりました。本研究の成果は核酸医薬等への応用展開も期待されます。
本研究は、CREST 「細胞機能を担う超分子複合体の原子分解能ダイナミクス」(課題番号:JPMJCR20E2 研究代表者:濡木 理)、官民研究開発投資拡大プログラム(PRISM)「ゲノム編集酵素の機能モジュールデータ基盤構築」(課題番号:JPJ008000 研究分担者:濡木 理)、日本学術振興会 科学研究費助成事業基盤研究(S)「反応場に着目したpiRNA経路の生化学的解析」(課題番号:18H05271 研究代表者:泊 幸秀)、基盤研究(B)「RNA依存性エフェクター複合体の構造機能解析」(課題番号:18H02384 研究代表者:西増 弘志)、特別研究員奨励費「ショウジョウバエのRNAサイレンシング関連因子の構造機能解析」(課題番号:21J11067 特別研究員:山口 そのみ)、ANRI基礎科学スカラーシップ「ショウジョウバエのRNAサイレンシング関連因子の構造機能解析」(山口 そのみ)などの支援により行われました。
発表雑誌
-
雑誌名 Nature 論文タイトル Structure of the Dicer-2–R2D2 heterodimer bound to a small RNA duplex 著者 Sonomi Yamaguchi, Masahiro Naganuma, Tomohiro Nishizawa, Tsukasa Kusakizako, Yukihide Tomari, Hiroshi Nishimasu, Osamu Nureki DOI番号
用語解説
注1 siRNA
小さなRNAの一種である低分子干渉RNA(small interfering RNA)の略称。21-23塩基長の一本鎖RNA。 ↑
注2 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸の立体構造の決定に利用されている。 ↑
注3 核酸医薬
DNAやRNAの構成成分であるヌクレオチドを基本骨格とする医薬品の総称。従来の低分子医薬品や抗体医薬品では狙えない核酸分子を創薬ターゲットとするため、次世代の医薬品として期待されている。 ↑
注4 トランスポゾン
ゲノム上を動く遺伝子。トランスポゾンの転移は遺伝情報の破壊につながる可能性をもつ。 ↑
注5 ガイド鎖
二本鎖siRNAのうち標的RNAと相補的な鎖のこと。こちらの鎖が取り込まれたArgonauteが標的RNAを認識・切断する。 ↑


