DATE2022.01.24 #Press Releases
オペロン構造の進化過程の実証実験に成功
金井 雄樹(生物科学専攻 博士課程)
津留 三良(生物普遍性研究機構 特任助教)
古澤 力(生物普遍性研究機構 教授)
発表のポイント
- 原核生物ゲノムの基本構造であるオペロン(注1) が挿入配列(注2)の働きで進化したとする新たな仮説を提唱し、その実証実験に成功しました。
- 世界で初めて、原核生物のオペロンが形成されていく進化過程を実験室で再現可能な形で観測しました。
- オペロンの進化をくりかえし観測できるようにしたことで、遺伝子制御機構がいかに進化し、複雑化してきたかの理解につながると期待できます。
発表概要
原核生物では、機能が関連した複数の遺伝子が、オペロンと呼ばれる構造にまとめられて制御されています。原核生物が持つ精巧なオペロンがいかにして生じてきたかは、古くから謎とされてきました。
今回、東京大学大学院理学系研究科の金井雄樹大学院生、津留三良特任助教、古澤力教授らは、原核生物のゲノムに普遍的な挿入配列と呼ばれる配列によって、オペロンを形成する進化が駆動されるとする新たな仮説を提唱しました。また、大腸菌を実験室で挿入配列の活性が高い条件で培養することで、仮説通りにオペロンが形成されうることを実証しました。これは、今まで未知であった原核生物のオペロンの形成メカニズムの一つを、進化過程の観測によって初めて実証した研究です。
病原性大腸菌O157などの病原菌でよく見られる挿入配列によってオペロンが形成されうることは、細菌の病原性の獲得や制御における新たな知見を与えるものです。また、本研究によって、オペロン形成をくりかえし再現できる実験条件が明らかになりました。この成果によって、今後、原始的な生物がオペロンを獲得して現生の原核生物へと近づいた過程の解明が期待できます。
発表内容
研究の背景・先行研究における問題点
オペロンはゲノムDNA上の複数の遺伝子が一つのプロモーター(注3) 下におかれた構造です。機能的に関連した遺伝子がオペロンにまとまっていると、環境に応じて複数の遺伝子を同時に制御できます。
オペロンという構造を取ることの合理性はさまざまな視点から検証されてきました。しかし、ランダムな変異による進化の過程で、DNA上の離れた位置にある複数の遺伝子が集まってオペロンを形成するメカニズムは分かっていませんでした(図1)。
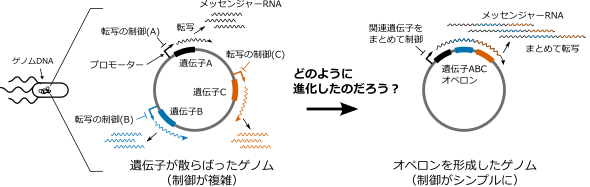
図1:研究の目的。オペロンを形成すると転写の制御が容易になり合理的であることは分かっている。しかしどのようにオペロンが進化するかは謎であった。
研究内容
挿入配列(図2-ア)はトランスポザーゼ遺伝子という一つの遺伝子をコードする配列でありながら、他の配列に挿入(Insertion)・切除(Deletion)・切り出し(Excision)などの多様な変異を生じさせる機能を持っており(図2-イ)、これらの個別の変異は頻繁に観測されてきました。挿入配列によって生じるこれらの変異が組み合わさることで、ゲノムDNA上の離れた位置にある複数の遺伝子が近づけられ、オペロン形成の進化が駆動されるというのが今回提唱したIDE(Insertion, Deletion, Excision)モデルによるオペロン形成(IDE仮説、詳細は図2-ウ)です。

図2:挿入配列によるオペロン形成の進化過程。(ア)挿入配列の構造。(イ)挿入配列が持つ三つの機能。挿入配列は四角形として簡略化して描いた。(ウ)IDEモデルによるオペロン形成に基づく進化過程の模式図。遺伝子を太矢印として描いた。オペロンは三段階で形成される。一:挿入配列が二つの遺伝子(黒色と橙色)の間に挿入される。二:挿入配列が周囲のDNAを高頻度で切除することで、二つの遺伝子が近づく。三:挿入配列が切除されオペロンが形成される。
提唱した仮説を実証するために、次のような実験を行いました。まず、挿入配列が抗生物質耐性遺伝子(注5) と赤と黄色の二色の蛍光タンパク質遺伝子(注6) の間に「挿入」されたDNA配列を持つ大腸菌を遺伝子組み換えにより用意しました(図3-ア、元の大腸菌のDNA配列)。この大腸菌を抗生物質の入った培地で培養することで、抗生物質耐性遺伝子と赤色蛍光タンパク質遺伝子が新しいオペロンを形成し、赤色蛍光をより強く示す変異体大腸菌が出現すると期待しました。また、IDEモデルによるオペロン形成には、挿入配列の切除・切り出し機能が多様な遺伝型を生み出すことが欠かせません。そこで、蛍光タンパク質遺伝子のオペロン形成を対象とすることで、大腸菌の蛍光強度を1細胞ごとに高速で測定し、挿入配列の活性が引き起こす遺伝的多様性を観測できるようにしました。

図3:抗生物質耐性遺伝子と赤色蛍光タンパク質遺伝子のオペロン形成の実証実験。(ア)IDEモデルによるオペロン形成前後の遺伝型変化。挿入配列の活性により抗生物質耐性遺伝子と赤色蛍光タンパク質遺伝子が近づき、オペロンを形成した。(イ)大腸菌の1細胞ごとの蛍光強度(左:挿入配列の活性なし;右:活性あり)。蛍光タンパク質遺伝子と周囲のプロモーターとの距離が挿入配列の切除や切り出し活性によって変わり、多様な蛍光強度を示している。(ウ)RT-PCR法(注8)でメッセンジャーRNAを検出した。(-)は偽陽性が出ないことの確認に使った条件を示す。(エ)赤色蛍光タンパク質遺伝子の発現量を抗生物質耐性遺伝子のプロモーター(薬剤添加に応じて転写活性が切り替わる)を介して制御できるようになったことを確認した。
大腸菌を実験室で1日(20世代弱)培養したところ、挿入配列の活性が高い条件下では多様な蛍光を持つ変異体が生じました(図3-イ)。その中からオペロンを形成した変異体を探し、遺伝型を調べるために、蛍光セルソーター(注7)で一部の細胞を分取しました。分取した細胞の遺伝型をDNAシーケンシングで調べたところ、IDEモデルに基づくオペロン形成を示す変異体であることがわかりました(図3-ア)。また、この変異体において、二つの遺伝子にまたがるメッセンジャーRNAが生成され(図3-ウ)、二つの遺伝子の転写が同時に制御されているのを確認しました(図3-エ)。この結果は、これらの遺伝子がオペロンの性質を持つことを意味します。挿入配列の活性に依存してこうした変異体が出現したことから、IDEモデルによってオペロンが形成されうることが実証されました。
今後の展開
挿入配列は、大腸菌に限らず多くの病原性の細菌で高い活性を持ちます。そのため、挿入配列によってオペロンが形成されうるとする仮説や実験証拠は、病原菌の持つ薬剤耐性や病原性といった特徴に関与するオペロンを獲得した経緯について新たな知見を与えるものです。
挿入配列は単純な遺伝子であり、原始的な細胞も類似した遺伝子を持っていた可能性があります。また、挿入配列が引き起こすさまざまな変異は、挿入配列自身の自己複製の機構と密接に関係しています。それゆえ、本研究は、生物が挿入配列のような「利己的」な遺伝子との共生の過程でオペロンを形成し、高度な遺伝子制御を獲得してきた可能性を示唆しています。
さらに、実証実験を通じて、挿入配列に駆動されたオペロンの形成過程を実験室でくりかえし再現できる条件が明らかになりました。本研究を発展させ、オペロンが原初の細胞で十分な速度で形成される条件を探ることで、生命がどのように複雑な遺伝子制御機構を獲得してきたかの理解につながると期待できます。
謝辞
本研究は、日本学術振興会・科学研究費助成事業(21J20693、 18H02427、17H06389)、科学技術振興機構(JST)・ERATO(JPMJER1902)などの支援を受けて行われました。
発表雑誌
-
雑誌名 Nucleic Acids Research 論文タイトル Experimental demonstration of operon formation catalyzed by insertion sequence著者 Yuki Kanai, Saburo Tsuru*, Chikara Furusawa*DOI番号 https://doi.org/10.1093/nar/gkac004
用語解説
注1 オペロン
DNAの配列情報として書かれた遺伝子は、プロモーター配列からメッセンジャーRNAへと転写され、さらにタンパク質に翻訳されて機能を発揮する。複数の遺伝子が単一のプロモーター配列からメッセンジャーRNAへと転写されるDNA配列の構造をオペロンという。遺伝子をオペロンにまとめることで機能的に関連した遺伝子群を同時に制御できるようになる(図1)。 ↑
注2 挿入配列
原核生物に普遍的に見られる、ゲノムとは独立に複製する単純な構造を持つ遺伝子の総称。挿入配列自身の自己複製のための酵素であるトランスポザーゼ遺伝子(とその関連遺伝子)および自身の境界を定める認識配列のみからなる(図2-ア)。 ↑
注3 プロモーター
メッセンジャーRNAを作る酵素であるRNAポリメラーゼが、転写を開始する目印として使うDNAの配列。 ↑
注4 オペロン説
1961年にジャコブとモノーが提唱した生物の遺伝子制御に関する仮説。生物の遺伝子発現制御の基本原理を予想した彼らは1965年に「酵素およびウイルス合成の遺伝的制御に関する発見」を理由にノーベル賞生理学・医学賞を受賞した。彼らは、大腸菌がラクトース代謝に関わる酵素の量を培地のラクトースの有無に応じて調節するという現象に注目し、大腸菌のラクトース代謝変異体の解析を行った。そこから、大腸菌がラクトース代謝を制御できるのは、ラクトース代謝に必要な酵素活性を持つ遺伝子の「メッセンジャー」(後のメッセンジャーRNA)の合成を抑制する遺伝子(リプレッサー)と、リプレッサーが認識して下流の遺伝子の発現を抑えるのに使われる遺伝子(オペレーター)を大腸菌が持っているからだと予想した。リプレッサーとオペレーターがあると仮定した上で、それらによって同時に制御される遺伝的単位(“genetic unit of co-ordinate expression”)のことを「オペロン」と名付けた。そして、ゲノム中にまとまって配置されている遺伝子群はまさにこのオペロンなのではないかと予想した。 ↑
注5 抗生物質耐性遺伝子
この遺伝子を発現する細菌は抗生物質を加えた培地でも育つようになる。 ↑
注6 蛍光タンパク質遺伝子
この遺伝子を発現する細胞は蛍光を持つようになり、生きたまま遺伝子の発現を調べられる。オワンクラゲの緑色蛍光タンパク質を改変してさまざまな色に光る蛍光タンパク質が開発されている。 ↑
注7 蛍光セルソーター
細い水流中に細胞を1細胞ずつ流し、蛍光を測定し、蛍光強度に応じて細胞を分取する装置。 ↑
注8 RT-PCR法
RNAをDNAに変換(逆転写)し、得られたDNAをPCRで増幅して検出する。RNAを検出する主要な方法。 ↑


