DATE2023.04.19 #Press Releases
ハエのアルゴノートタンパク質の新機能
――互いに結合して凝集する――
成田 晴香(研究当時:生物科学専攻 博士課程/日本学術振興会特別研究員)
島 知弘(生物科学専攻 助教)
飯塚 怜(生物科学専攻 助教)
上村 想太郎(生物科学専攻 教授)
発表のポイント
- アルゴノートとよばれるタンパク質の一部分には、「アミロイド様凝集体」という塊を形成する能力があることを発見しました。
- 凝集体を形成できるこの部分は、一部の生物のアルゴノートにのみ備わっていて、その機能はこれまで分かっていませんでした。
- 本研究成果は、生物の遺伝子発現の新たな調節法の理解につながる可能性があります。
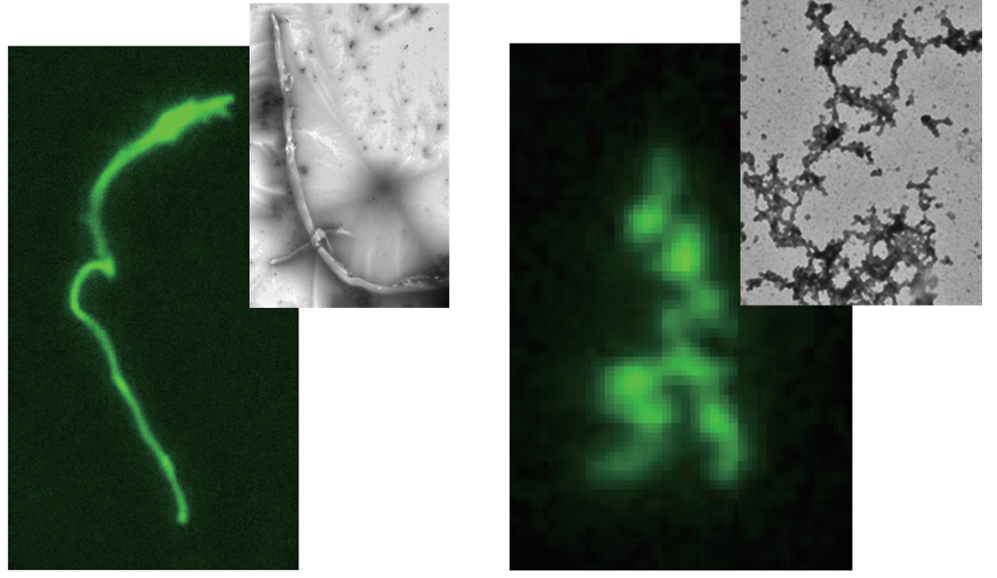
アルゴノートタンパク質の断片によってできた凝集体の顕微鏡像
発表概要
東京大学大学院理学系研究科の成田晴香大学院生(研究当時)と島知弘助教、飯塚怜助教、上村想太郎教授による研究グループは、キイロショウジョウバエ(注1)のアルゴノートと呼ばれるタンパク質の一部分が集まって凝集する能力を持つことを明らかにしました。
アルゴノートは、多様な遺伝子の発現(注2)を調節しています。この現象はRNAサイレンシングとよばれており、臓器の形成や免疫といったさまざまな生命現象に重要な役割を果たしています。一部の生物のアルゴノートには、機能の分からない不思議な領域がありました。本研究では、この領域が多数集まってアミロイド様凝集体(注3)という塊を形成する能力があることを発見しました。
近年、タンパク質やDNAなどが凝集することで、これらの生体分子の活性が調節されるという現象が多数報告されています。今回の発見から、アルゴノートによるRNAサイレンシングも、この領域による凝集によって調節されている可能性が出てきました。RNAサイレンシングは生物が遺伝子発現を調節する重要な仕組みであり、今回の成果は遺伝子発現の新たな調節法の理解につながる知見になります。
発表内容
アルゴノートとよばれるタンパク質は、遺伝子の情報にしたがってタンパク質などが作られる過程を調節するRNAサイレンシングという現象をつかさどっています。RNAサイレンシングは臓器の形成や免疫といったさまざまな生命現象に重要な役割を果たしており、また多くの生物学の研究にも活用されてきました。そのため、これまでにアルゴノートの機能や活性はよく調べられてきましたが、昆虫や植物を含む一部の生物種のアルゴノートには、特定の構造を取らず機能が分からない領域が存在していました。とくに、RNAサイレンシング研究に良く用いられてきたキイロショウジョウバエのアルゴノートの一種では、このタンパク質全体の約1/3にも及ぶ範囲が機能不明な領域で占められていることが知られていました。以後、この領域をNterと呼びます。

図1:Nterのアミノ酸配列
タンパク質は20種類のアミノ酸が順番に並んでできているが、Nterの領域ではそのうちの一種(グルタミン、赤字のQ)が全体の40%以上を占めている。Nter以外の部分ではグルタミンの含有率は約4%にとどまっており、Nterの配列の特殊性が際立つ。右端の数字はアルゴノートタンパク質全体における何番目のアミノ酸であるか示している。
本研究では、このNter領域が特徴的な配列をしていることに着目して(図1)、その機能を調べました。まずNterの配列をコンピュータで解析したところ、アミロイド様凝集体と呼ばれる多数のタンパク質が集まった塊を形成するタイプのタンパク質に非常に近い配列であることが分かりました。そこで、Nterがアミロイド様凝集体を形成するかどうかを以下の3つの方法で実験的に検証しました。
1) 生化学的な検証
アミロイド様凝集体の中にあるタンパク質同士は強固に結合しており、通常のタンパク質同士の結合であれば離れてしまうような薬剤の存在下でも凝集体を維持することが知られています。Nterによってできた凝集体も、このような薬剤存在下でも凝集体を維持しており、アミロイド様凝集体の特徴に合致しました。
2) アミロイド検出試薬による検証
アミロイド様凝集体が持つ特有の構造に結合して光るアミロイド検出試薬があります。Nterによってできた凝集体もこのアミロイド検出試薬を光らせることから、アミロイド様凝集体特有の構造を持っていることが示唆されました。
3) 顕微鏡による観察
Nterによってできた凝集体の様子を顕微鏡で直接観察したところ、一部の凝集体はアミロイド様凝集体によくみられる細い糸状の形をしていました。しかし、多くの凝集体はそれとは異なり、フラクタル状(注4)と呼ばれる形状を取っていました(図2)。また、小さなフラクタル状凝集体同士が結合して、大きなものへと成長していく様子も観察され、どのようにNterの凝集体ができてくるのかについてのモデルを提唱しました。
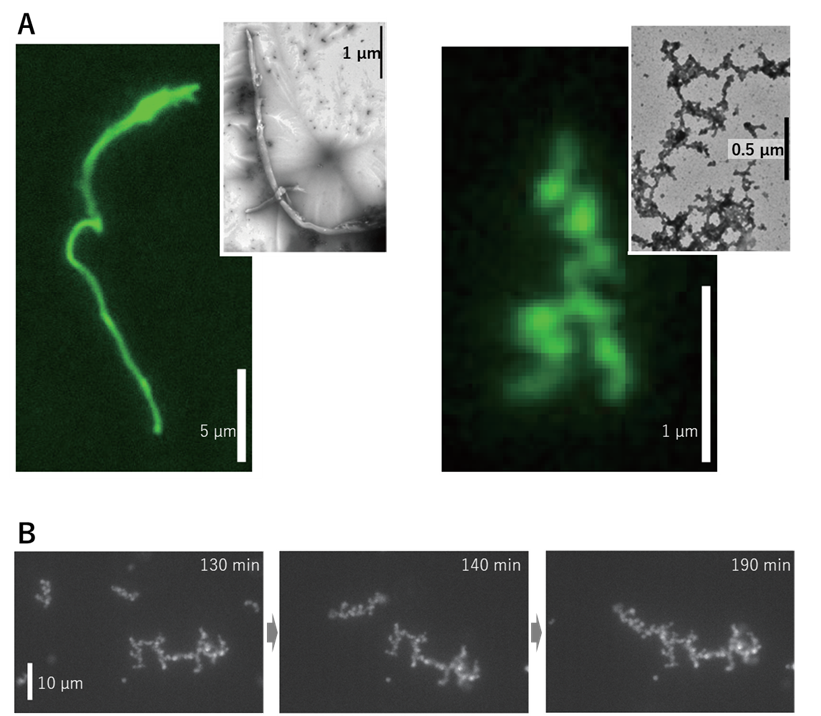
図2:Nterがあつまってできた凝集体の顕微鏡像
A. Nter凝集体には糸状のものも存在していたが(左)、大半はフラクタル状凝集体とよばれる形状をとっていた(右)。
B. フラクタル状凝集体同士が結合し大きくなっていく様子。右上の数字は、凝集をはじめてからの時間。
本研究で、キイロショウジョウバエに加えて、モデル植物であるシロイヌナズナのアルゴノートにも凝集できる能力が示す領域があることを示しました。さらに、タンパク質の配列の解析から、昆虫や植物を中心に多種のアルゴノートがNterと同様の性質の領域をもつことが示唆されました。近年、凝集することでその中に含まれるタンパク質の活性が調節されるという現象が多数報告されています。本研究の成果から、アルゴノートによるRNAサイレンシングもタンパク質の凝集によって細やかな調節がなされている可能性が示されました。今後、Nterによる凝集の生理的な役割をより詳細に調べることで、遺伝子発現の新たな調節法の理解につながるものと期待されます。
論文情報
-
雑誌名 BMC Biology 論文タイトル N-terminal region of Drosophila melanogaster Argonaute2 forms amyloid-like aggregates 著者 Haruka Narita, Tomohiro Shima*, Ryo Iizuka, Sotaro Uemura DOI番号
研究助成
本研究は、科研費「特別研究員奨励費(課題番号:21J11219 研究代表者:成田 晴香)」、「基盤研究(C)(課題番号:18K06147 研究代表者:島 知弘)」、「新学術領域研究(課題番号:19H05379, 21H00387 研究代表者:島 知弘)」の支援により実施されました。
用語解説
注1 キイロショウジョウバエ
俗に「コバエ」と呼ばれるハエの一種。研究上の多くの利点があり、生物学実験で広く利用されています。↑
注2 遺伝子の発現
細胞内に含まれる遺伝情報に基づいて、特定のタンパク質などがつくられること。↑
注3 アミロイド様凝集体
多数のタンパク質が特有の構造をとるように秩序よく結合して、糸状の塊となったものがアミロイドです。一部の性質のみが一般的なアミロイドに当てはまらない凝集体も含めて分類する場合、アミロイド様凝集体と呼ばれます。アミロイド様凝集体が器官に異常に蓄積すると、アルツハイマー型認知症や関節リウマチに代表されるアミロイド症の原因になると言われています。↑
注4 フラクタル状
凝集体のうち、一本の細長い形状ではなく、同じ形状の小さな凝集体が集まって、サイズは大きいが形状は元の小さなものと似た凝集体を形成しているように見えるものをフラクタル状凝集体と呼びます。フラクタル状凝集体は、どれだけ分解していっても同じ形状になるというわけではないので、幾何学的なフラクタル図形の定義にはあてはまりません。↑


