DATE2023.10.11 #Press Releases
化成品合成を革新するグリーン反応を実現
山下 恭弘(准教授)
小林 修(教授)
発表のポイント
- アルケンを用いたカルボニル化合物α位でのアルキル化反応を開発し、現行法に比べて廃棄物の大幅削減を達成した。
- 青色光照射下、有機光触媒とリチウムチオフェノキシド触媒を用いることで、活性メチレン化合物とさまざまな不活性アルケンとの反応が穏和な条件で円滑に進行した。
- 医薬品や農薬、機能性化学品の連続合成への展開、廃棄物削減による脱炭素社会への貢献が期待される。
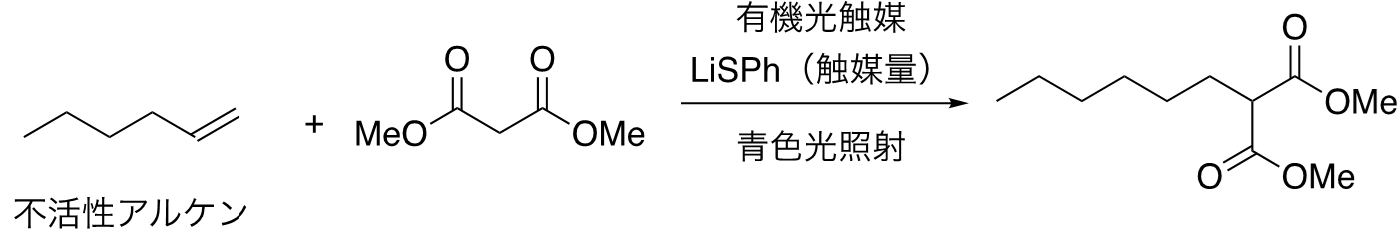
本研究の概要図
発表概要
東京大学大学院理学系研究科の山下准教授、小林教授らの研究グループは、カルボニル基α位で行う炭素―炭素結合生成反応を、入手容易で安定な炭化水素原料を用いて廃棄物の少ない方法で効率的に実現した。
カルボニル基α位でのアルキル化反応は、有機合成化学において汎用される最も基本的な炭素―炭素結合生成反応の一つである。しかしこの反応では、従来ハロゲン等の脱離基をもつ炭化水素化合物を原料として使用しなければならず、その脱離基由来の多量の廃棄物が発生しており問題となっていた。今回発表者らは、原料として脱離基を持たない炭素―炭素二重結合をもつ炭化水素化合物(アルケン)を用いるアルキル化反応の検討を行い、有機光触媒(注1)である2,4,5,6-テトラキス(9H-カルバゾール-9-イル)イソフタロニトリル (4CzIPN)とリチウムチオフェノキシド(LiSPh)触媒を用いることで、青色光照射下マロン酸エステル等の活性メチレン化合物(注2)と1-デセン等の不活性アルケン(注3)によるアルキル化反応(注4)が室温で円滑に進行することを見出した。この反応は、低触媒量で進行し、不活性アルケンに対する活性メチレン化合物の量も小過剰で良いことから非常に効率的である。また、用いることのできる原料も幅広く、立体的に嵩高いアルケンやさまざまな官能基をもつアルケン、通常液相反応では使用が困難な常温常圧でガス状のアルケンを用いる反応でも高収率で目的物を得ることができた。さらに、本手法により医薬品やその中間体の合成の検討を行い、医薬品であるブコローム(bucolome)とバルプロ酸ナトリウム(Sodium valproate)を効率的に合成することができた。この反応は連続フロー合成にも適用可能であり、光反応チューブを用いた連続的反応を効率的に行うことができた。
本研究は、効率的かつ廃棄物が極小であるためカルボニル化合物のα位でのアルキル化反応を革新できるものであり、既存のアルキル化反応を本手法で置き換えることができるため、産業界での広い応用が期待できる。本研究によって、医薬品や農薬、機能性化学品合成の効率化による脱炭素社会への貢献が期待される。
発表内容
〈研究の背景〉
昨今の環境汚染やエネルギーの浪費問題がクローズアップされる中、その問題を解決するグリーン・サスティナブルケミストリーの実現は有機合成化学者にとって重要な使命の一つである。この中でも医薬品や農薬、機能性化学品等のファインケミカルズの供給は人類の福祉を維持していくために必要不可欠なものであり、その迅速な供給が社会から強く望まれている。これまでに多くの化学産業がさまざまな製品を生み出し市場に供給しているが、このような製品の生産に伴い副生する二酸化炭素の放出や、多量の廃棄物の発生が地球環境に大きな影響を与えることが社会問題になっている。よって有機合成化学の観点からは、廃棄物を最小限に抑え、かつ持続可能なエネルギーを用いる反応手法を開発していく必要がある。
炭素―炭素結合生成反応は、さまざまな分子の基本骨格を構築する重要な有機化学反応であり、その中でもカルボニル基(注5)α位でのアルキル化反応は、有機合成化学において汎用される最も基本的な反応の一つである。これまでこのアルキル化反応は、ハロゲン等の脱離基をもつ炭化水素化合物を原料として用いており、産業スケールでの反応も行われてきたが、反応を進行させるためには常に化学量論量(注6)の塩基試薬が必要であり、また原料としてハロゲン等の脱離基をもつ炭化水素化合物を使用しなければならないことから、塩基試薬と原料の脱離基由来の廃棄物が常に多量に発生していた。その一方で、炭素―炭素二重結合をもつ炭化水素化合物(アルケン)をアルキル化反応の原料として用いる反応は、脱離基由来の廃棄物が生じないため地球環境にとっても望ましい反応であるが、用いることのできるアルケンの構造の制約が大きかった(図1)。これまでの研究では、アルケンに電子求引性基(注7)が結合した求電子性(注8)の高い活性アルケンを用いる反応が数多く開発されてきたが、電子求引基を持たない不活性アルケンを用いた場合にはその反応性が十分でないため望みの反応が進行しないことが多かった。このようなアルケンを原料として用いるアルキル化反応の開発は有機合成化学の方法論を大きく変えることができるため、合成プロセスの大幅な改善に繋がると考えられる。
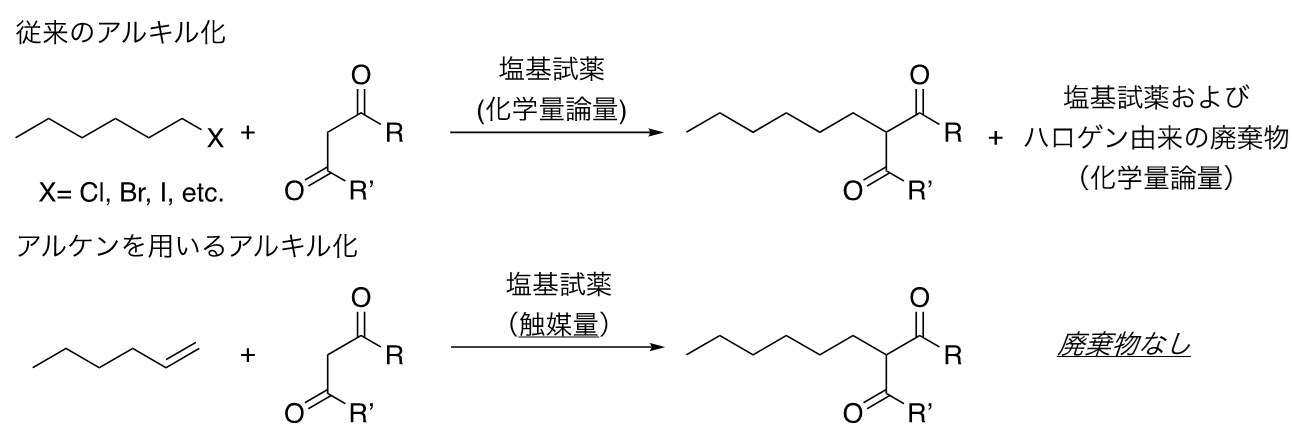
図1:従来のアルキル化反応と今回の反応
〈研究の内容〉
本研究では、マロン酸エステルのようなカルボニル基α位に酸性度の高い水素原子をもつような活性メチレン化合物と不活性アルケンとの反応の検討を行った。この反応はこれまで報告されている手法では、溶媒量の酢酸の使用や使用可能なアルケンの制限、高価な希少遷移金属の使用や高温条件、多量の水素原子移動触媒の使用といった問題等、大幅に改善すべき点が多かった。また発表者らもマロン酸エステルのスチレン等の芳香環が隣接するアルケンを求電子剤として用いるアルキル化反応を開発していたが、電子求引性基を持たないアルキル基が置換したような不活性アルケンを用いる反応は実現できていなかった。
今回、マロン酸ジメチルを原料として用い、不活性アルケンである1-デセンとの反応の検討を行ったところ、有機光触媒である2,4,5,6-テトラキス(9H-カルバゾール-9-イル)イソフタロニトリル (4CzIPN)とリチウムチオフェノキシド(LiSPh)を用いた際に、目的の反応が青色光照射下室温で円滑に進行することを見出した(図2)。有機光触媒は高価な遷移金属を含まないため、より経済的な光触媒である。反応条件の最適化を行ったところ、アセトニトリル(MeCN)-テトラヒドロフラン(THF)混合溶媒の使用が適切であり、触媒量も光触媒0.5 mol%、LiSPhを2 mol%まで低減化しても目的の反応は進行した。また、不活性アルケンに対する活性メチレン化合物の量も小過剰で良いことから非常に効率的である。用いることのできる原料も幅広く、立体的に嵩高いアルケンやさまざまな官能基をもつアルケン、通常液相反応では使用が困難な常温常圧でガス状のアルケンも使用することができた。また、さまざまな活性メチレン化合物や活性メチン化合物も使用可能であることがわかった。さらに、本手法を用いる医薬品の合成の検討を行い、抗炎症・痛風治療薬であるブコローム(bucolome)や抗てんかん薬であるバルプロ酸ナトリウム(Sodium valproate)を効率的に合成することができた。また、この反応は連続フロー合成にも適用可能であり、光反応チューブを用いた連続的反応を効率的に行うことができた。
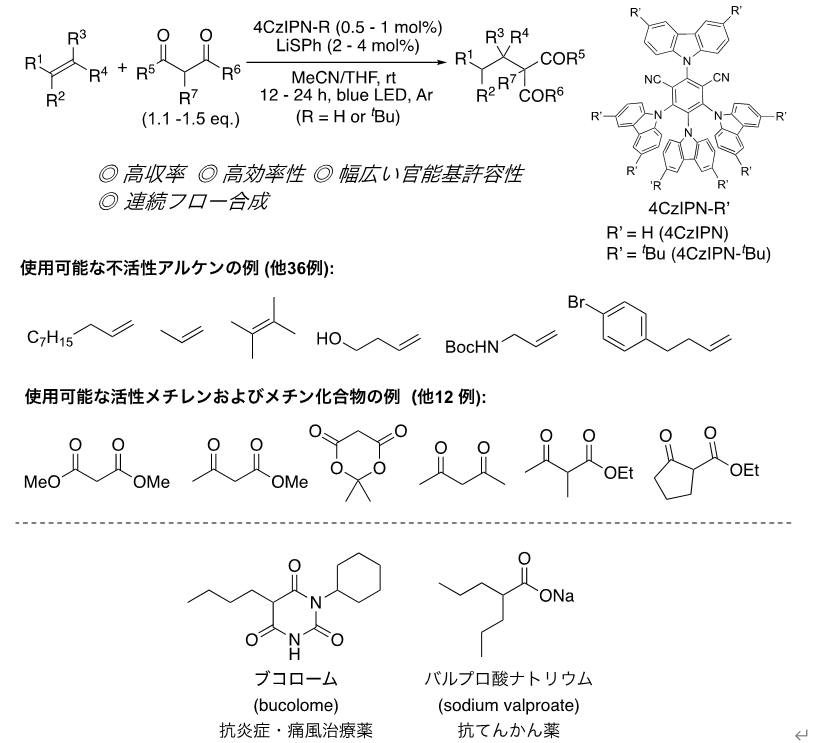
図2:有機光触媒を用いる不活性アルケンと活性メチレン化合物のアルキル化反応
この反応では、LiSPhを用いることが鍵であり、まずLiSPhが原料のマロン酸エステルを脱プロトン化して対応するエノラートを生成し、このエノラートを光照射で活性化された光触媒が一電子酸化してα-カルボニルラジカル(注9)が生成する。カルボニルα-ラジカル種はカルボラジカル(注10)の一種であり、カルボアニオン種(注11)であるエノラートと比べてアルケンに対して反応性が高いことが知られている。ここでは、このα-カルボニルラジカルがアルケンと反応してラジカル中間体が生成し、反応系中で生成したベンゼンチオール(PhSH)がこのラジカル中間体を捕捉して目的物が生成すると考えている(図3)。このようにLiSPhは多機能触媒として機能している。
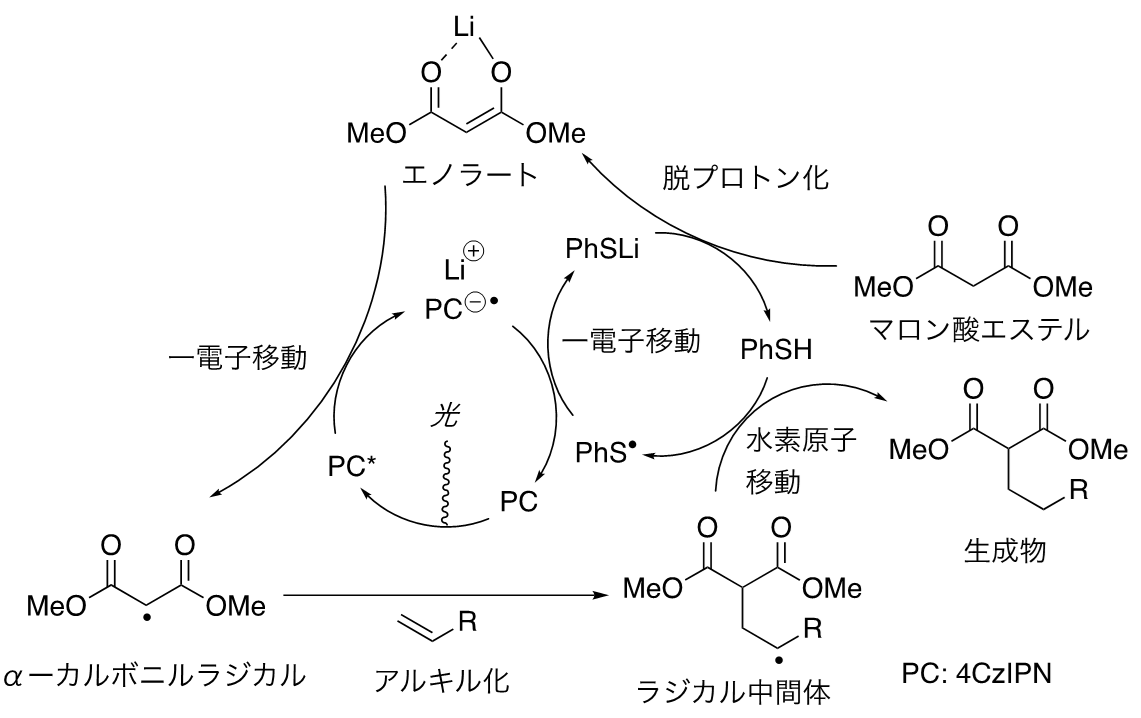
図3:推定触媒反応機構
以上、本研究では、従来の反応では原料として使用することのできない不活性アルケンを用いる活性メチレンとのアルキル化反応を高効率的に実施することができた。本研究は、廃棄物が極小であるためカルボニル化合物のα位でのアルキル化反応を革新できるものであり、今後有機合成化学で広く用いられると考えられる。
<今後の展望>
本研究で得られた成果により、既存のカルボニル化合物のアルキル化反応を本手法で置き換えることができると考えられ、産業界での広い応用が期待できる。本研究によって、医薬品や農薬、機能性化学品合成の効率化による脱炭素社会への貢献が期待される。
論文情報
-
雑誌名 Journal of the American Chemical Society 論文タイトル Photoinduced Efficient Catalytic α-Alkylation Reactions of Active Methylene and Methine Compounds with Nonactivated Alkenes著者 Yasuhiro Yamashita*, Yoshihiro Ogasawara, Trisha Banik, and Shū Kobayashi*DOI番号
研究助成
本研究は、国立研究開発法人 新エネルギー・産業技術総合開発機構 (NEDO)「機能性化学品の連続精密生産プロセス技術の開発(課題番号 JPNP19004)」、および文部科学省科学研究費新学術領域「ハイブリッド触媒」計画研究「強塩基ハイブリッド触媒系の開発および高立体選択的分子骨格構築反応への展開(課題番号17H06448)」の一環として行われました。
用語解説
金属を含まない光触媒。光触媒は照射された光エネルギーを吸収して活性化され、原料と反応して目的の反応を促進する機能を持つ。↑
主に二つの電子求引性基に置換されたメタンのこと。炭素上の水素原子がプロトンとして脱離しやすい性質を持つ。↑
電子的に偏りが小さいアルケン。偏りが小さいため反応しづらい。↑
炭素―炭素結合生成反応の中で、置換反応や付加反応による炭素―炭素結合生成反応の総称。置換反応とは炭素原子上の脱離基が反応剤の炭素原子と置き換わる反応。付加反応とは、炭素―炭素多重結合に反応剤の炭素原子が反応して、その多重度が減少した生成物ができる反応。↑
炭素―酸素二重結合のこと。↑
原料に対して同じ物質量(モル数)のこと。↑
電子を引っ張る性質を持つ官能基。↑
電子を受け入れやすい性質のこと。電子豊富な炭素原子と反応する。↑
カルボニル基炭素に結合している炭素原子が不対電子を持つ化学種。ラジカルとは不対電子を持つ原子や分子のこと。↑
炭素原子のラジカル種のこと。↑
炭素原子上にアニオン(マイナス電荷)をもつ化学種のこと。↑


