DATE2023.09.15 #Press Releases
アンジェルマン症候群の責任因子Ube3aは、不要シナプス除去を促進して脳の機能発達を誘導する
古澤 孝太郎(生物科学専攻 特任助教)
石井 健一(生物科学専攻 助教)
辻 真人(生物科学専攻 助教)
徳光 和波(生物科学専攻 修士課程:研究当時)
長谷川 恵里(生物科学専攻 特任助教:研究当時)
榎本 和生(生物科学専攻 教授/ニューロインテリジェンス国際研究機構副機構長・主任研究者)
発表のポイント
- 遺伝性発達障害疾患アンジェルマン症候群の責任因子であるUbe3aが、シナプス前部のBMP受容体の分解を介して、シナプス除去を促進することを発見した。
- アンジェルマン症候群患者に見られるUbe3a遺伝子変異の一部は、Ube3aのシナプス前部への輸送を阻害することを示した。
- 本研究から、シナプス前部のUbe3a活性が適正に保たれないと、シナプス数やシナプス活動に異常が生じ、その結果として発達障害や自閉症につながる可能性が示唆された。
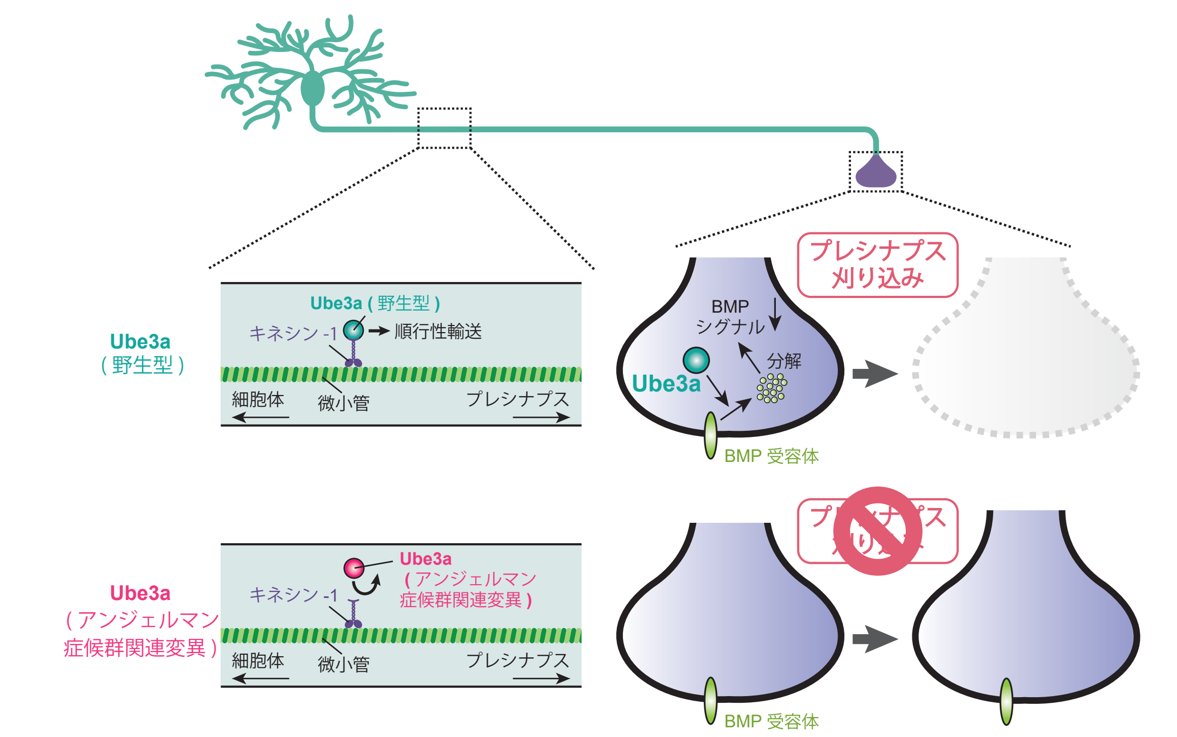
Ube3aはシナプス前部でBMP受容体を分解しシナプス除去を誘導する
発表概要
出生直後のヒト脳には神経回路の混線・脱線が多数含まれており、機能的に未熟な状態にあると考えられます。生後の発達段階において、さまざまな外部情報が脳に入るようになると、それに応じて不要なシナプス(注1)接続を除去することにより、脳は機能的な情報処理回路へと成熟することが分かっています。一方で、発達障害患者の脳ではシナプス除去がうまく進行していない可能性が示唆されており、このことからも、脳機能成熟におけるシナプス除去の重要性が指摘されています。しかし、発達期の哺乳類の脳神経回路を扱う技術的な難しさから、生体内で不要シナプスを選択的に除去するメカニズムについては、未だ十分に理解されていません。
今回、東京大学大学院理学系研究科生物科学専攻の古澤孝太郎特任助教、石井健一助教、辻真人助教、徳光和波大学院生(研究当時)、長谷川恵里特任助教(研究当時)、榎本和生教授(ニューロインテリジェンス国際研究機構(WPI-IRCN)副機構長・主任研究者)は、ショウジョウバエ神経回路を解析モデルとして、遺伝性発達障害疾患アンジェルマン症候群の責任因子であるUbe3a E3リガーゼ(注2)が、シナプスのBMP受容体(注3)の分解を介して、不要なシナプスの除去を促進することを示しました。さらに、アンジェルマン症候群患者に見られる遺伝子変異の一部が、Ube3aのシナプスへの輸送を阻害することを示しました。逆に、シナプスのUbe3a量の上昇は過剰なシナプス刈り込みを誘導することを示し、自閉症の原因となる可能性を示しました。本研究は、不要シナプス除去の基本メカニズムの理解につながるとともに、アンジェルマン症候群や自閉症の発症メカニズムの理解や治療薬の開発に貢献する可能性があります。
発表内容
〈研究の背景〉
アンジェルマン症候群(Angelman Syndrome: AS)は、言語障害、運動失調、てんかん発作などを主徴とする遺伝性発達障害疾患です。ASの責任因子(注4)としてUbe3aが同定されており、そのアミノ酸配列からユビキチンE3リガーゼとして働くことが示唆されています。実際、Ube3aは細胞内や試験内でさまざまな異なるタンパク質にユビキチン鎖を付加することにより分解へと導くことが示されています。一方で、免疫染色法や電子顕微鏡による研究から、Ube3aは神経細胞のシナプス前部に強く発現することが示されていますが、Ube3aがシナプス前部でどのような生理機能を果たしているのかについては解明されていませんでした。
〈研究の内容〉
今回、東京大学の榎本和生教授の研究グループは、ショウジョウバエ神経系を解析モデルとして、シナプス前部のUbe3aが不要なシナプス除去に必須であることを発見しました。さらに、Ube3aがキネシン・モータータンパク質との相互作用を介して、シナプス前部へと輸送されることを示しました(図1)。これまでのAS患者の遺伝子解析から、Ube3aタンパク質内に100を超える数の異なる点変異(注5)(以降、AS変異と総称)が報告されていますが、ほとんどのAS変異はUbe3aの機能にどのような影響を与えるのか理解されていません。研究グループは、Ube3aの中央部がキネシン・モータータンパク質との相互作用に重要であることを示し、中央部に位置するAS変異がキネシン・モータータンパク質との相互作用を強く阻害することを示しました。さらに、中央部にAS変異を持つUbe3aは、E3リガーゼ活性を完全に欠損させたUbe3aと同様に、シナプス除去を誘導できないことを発見しました。これらの結果から、シナプス前部のUbe3 E3リガーゼ活性が、不要シナプス除去に必須であることがわかりました。
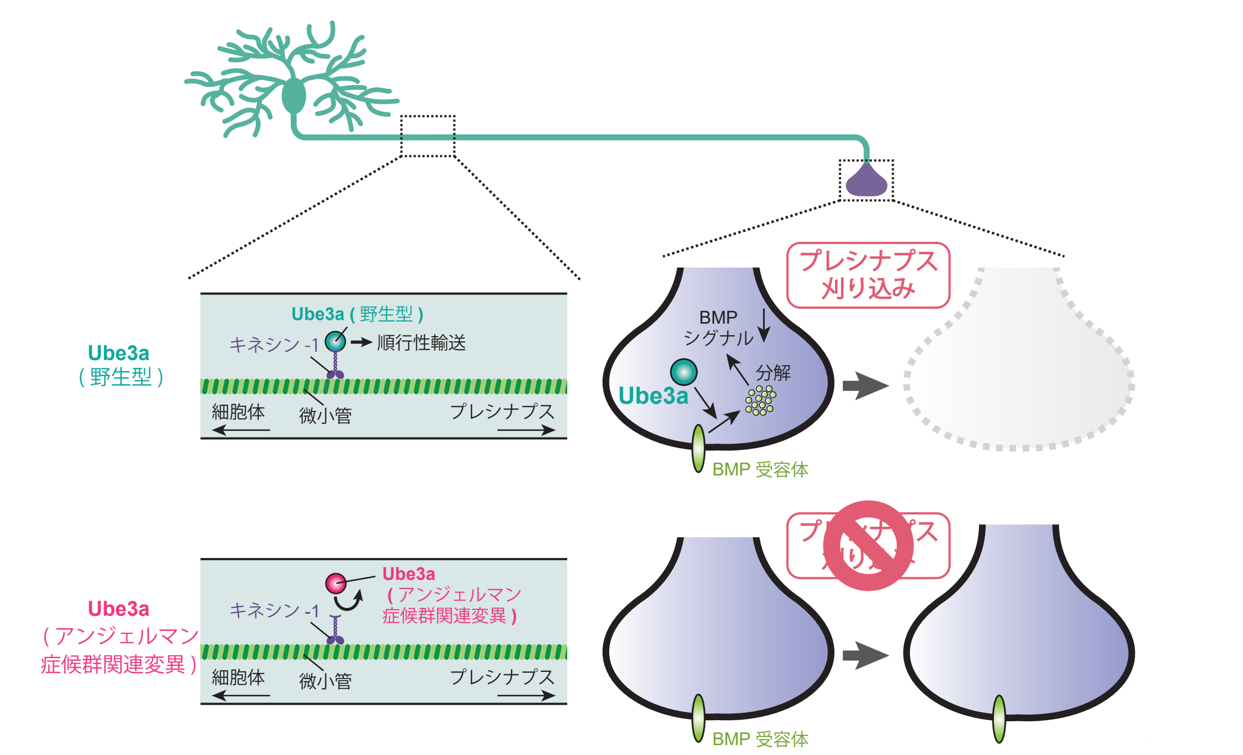
図1:Ube3aはキネシンモーターとの相互作用を介してシナプス前部へと輸送される
さらに研究グループは、シナプス前部におけるUbe3aの生理機能を追求し、Ube3aはシナプス前部のBMP受容体を分解することにより、BMPシグナルを抑制することを示しました(図1)。過去の研究から、シナプスのBMPシグナルはシナプス形成・維持に働くことが報告されており、Ube3aはシナプス前部のBMP受容体を分解することにより、シナプスの不安定化を引き起こしてシナプス除去を促進することが示されました。
逆に、シナプス前部のUbe3a活動を上昇させる操作を行うと、過剰なシナプス除去が誘導されシナプス伝達機能が抑制されることがわかりました。一部の自閉症患者では、Ube3a遺伝子を含む遺伝子座(ヒト染色体15q11-13)の重複が見られ、Ube3aの発現量が上昇していることが知られています。今回の研究から、Ube3a量の異常上昇は過剰なシナプス除去を誘導し、その結果として、正常なシナプス活動を阻害する可能性が考えられました(図2)。
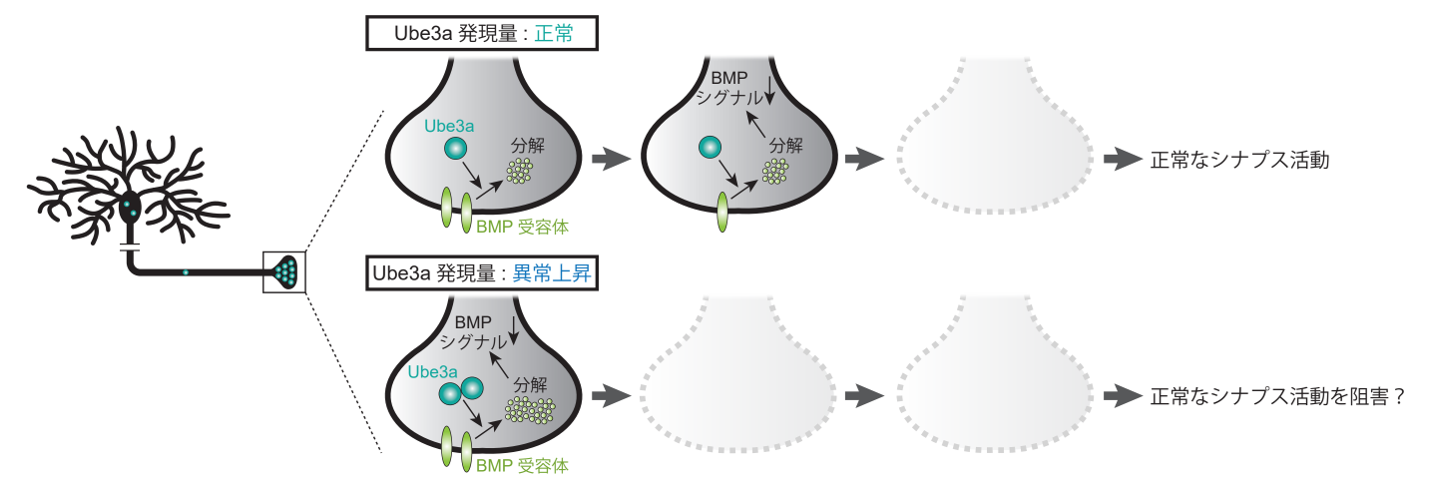
図2:異常なUbe3a活性上昇は、過剰なシナプス除去を誘導する
以上の結果から、シナプス前部のUbe3aは不要シナプスの除去を介して脳機能の発達を促す働きがあり、Ube3aが不活性化する、もしくは正常にシナプス前部へと輸送されないと、不要シナプス除去が進まず、脳の機能成熟が阻害される可能性が示唆されました。
本研究は、不要シナプス除去の新たな分子メカニズムを解明するとともに、発達障害および自閉症の発症メカニズムを示唆しました。また、Ube3a変異体における不要シナプス除去不全はBMP阻害剤の投与により一部回復することから、シナプスBMPシグナルがアンジェルマン症候群の治療のターゲットとなる可能性が考えられます。
論文情報
-
雑誌名 Science 論文タイトル Presynaptic Ube3a E3 ligase promotes synapse elimination through downregulation of BMP signaling著者 Kotaro Furusawa, Kenichi Ishii, Masato Tsuji, Nagomi Tokumitsu, Eri Hasegawa and *Kazuo Emoto (*責任著者)DOI番号
研究助成
本研究は、新学術領域研究「スクラップ&ビルドによる脳機能の動的制御(課題番号16H06456)領域代表:榎本和生」、基盤研究(A)「神経回路の組織化と維持・管理を担う分子細胞基盤(課題番号16H02504)研究代表:榎本和生」、AMED-CREST「痛覚感受性の組織発達制御メカニズムの包括的理解と新規研究プラットフォーム創出を目指した研究(課題番号JP21gm1310010)研究代表:榎本和生」などのサポートにより実施されました。
用語解説
神経細胞間の接続部位のこと。化学シナプスでは、シナプス前部から放出される神経伝達物質をシナプス後部の受容体が受け取ることにより、神経情報伝達が進行する。↑
細胞内でタンパク質を分解するユビキチン・プロテオソーム・システムにおいて働く酵素であり、ユビキチン鎖を特定のタンパク質へと結合させることにより、そのタンパク質をプロテオソームによる分解へと導く。↑
BMPを含むTGF-βスーパーファミリータンパク質によって活性化される膜貫通型のセリン/スレオニンリン酸化酵素受容体である。活性化されたBMP受容体は、細胞内にシグナルを伝達する。↑
特定のタンパク質の機能が失われたことにより特定の疾患が引き起こされる場合、そのタンパク質を、疾患の責任因子とよぶ。↑
タンパク質をコードする遺伝子内に変異が起きることにより、単一のアミノ酸が他のアミノ酸へと置換されること。点変異が入る場所によっては、そのタンパク質の機能が欠損もしくは低下し、その結果、発病につながると考えられている。↑


