DATE2022.11.04 #プレスリリース
哺乳類においてリボソームの衝突に対処する仕組み
―ユビキチン修飾を介した翻訳停滞の解消を試験管内で再現―
東京大学医科学研究所
東京大学大学院理学系研究科
発表概要
リボソームが翻訳途中に強く停滞すると、後続のリボソームとの衝突を引き起こします。衝突リボソームは 不良タンパク質の産生を引き起こすため、品質管理機構RQC((Ribosome-associated Quality Control)により認識・排除される必要があります。RQCの欠損は、モデル生物における寿命の短縮や神経変性疾患との関連が明らかになっています。
今回、東京大学 医科学研究所RNA制御学分野/大学院理学系研究科生物科学専攻/大学院新領域創成研究科メディカル情報生命科学専攻の稲田利文教授と、東北大学大学院薬学研究科の成田桃子大学院生、ミュンヘン大学Gene CenterのRoland Beckmann教授らの研究グループは、主に出芽酵母を用いた先行研究により、RQCは①衝突リボソームのユビキチン化 ②リボソームサブユニット解離 ③合成途中の不良タンパク質の分解といった分子機構で行われることを報告してきました。しかし、哺乳類におけるRQCの分子機構には不明な点が多く残されていました。
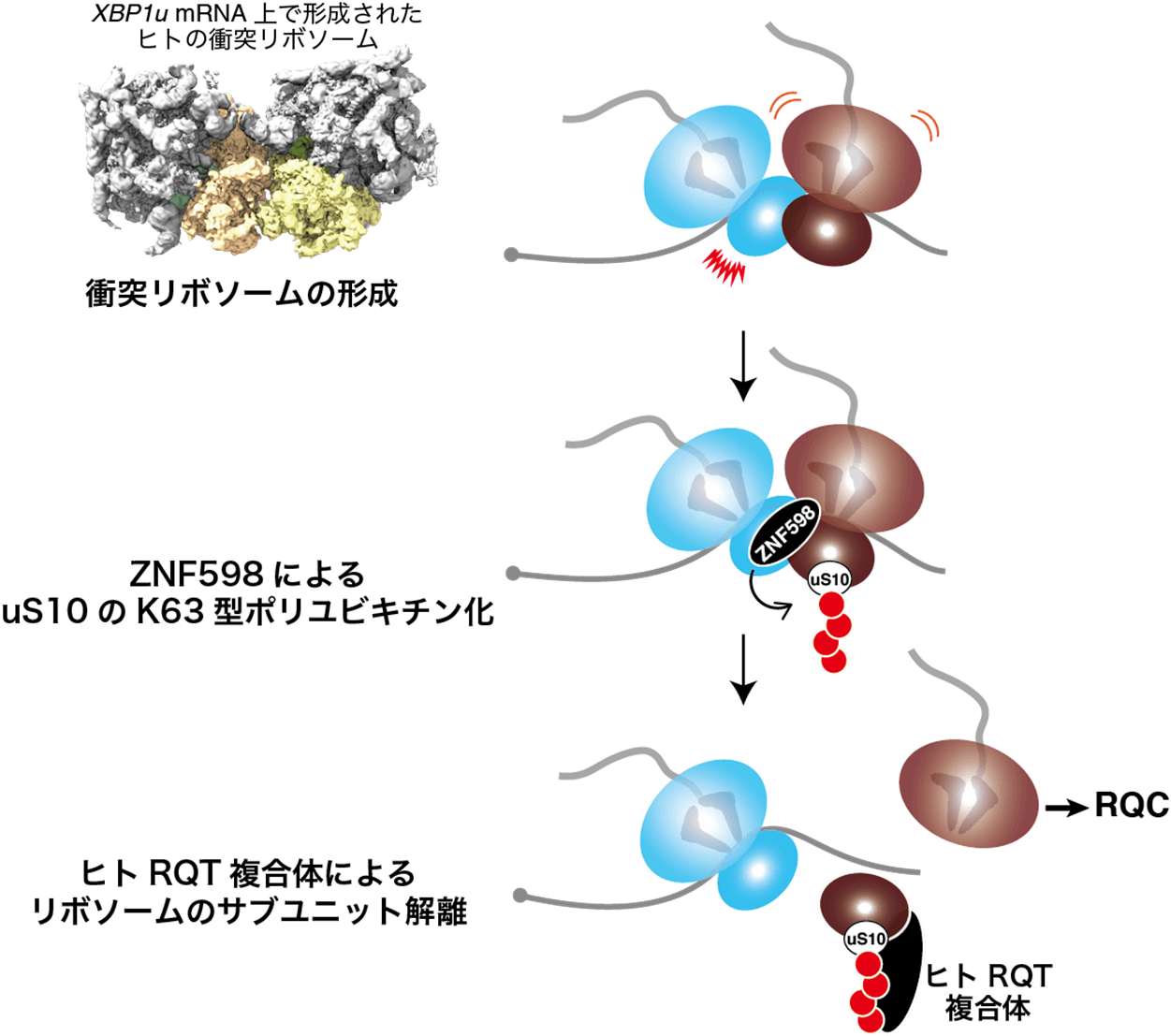
研究グループは、内在性の翻訳停滞配列を用いた試験管内の再構成実験により、哺乳類における衝突リボソームへの新規ユビキチン修飾としてK63型ポリユビキチン修飾を発見し、K63型ポリユビキチン修飾を目印として衝突リボソームのサブユニット解離が誘導されることを明らかにしました。さらに、クライオ電子顕微鏡を用いた構造解析により、ヒトの衝突リボソーム構造を初めて決定しました。また、出芽酵母の衝突リボソーム構造との違いを発見し、ヒトの衝突リボソームは、進化上で出芽酵母とは異なる制御機構を獲得している可能性を見出しました。
本成果は、衝突リボソームの蓄積が関連するさまざまな神経系疾患の発症機構の理解や、新規治療戦略の開発につながることが期待されます。
本研究は、日本医療研究開発機構(AMED-CREST 課題番号:20gm1110010h0002、研究代表者:稲田利文)、日本学術振興会科学研究費助成事業(課題番号:19H05281, 21H05277, 22H00401、稲田利文;21H00267, 21H05710, 松尾芳隆)、科学技術振興機構(JST)さきがけ(課題番号:JPMJPR21EE、研究代表者:松尾芳隆)などの支援を受けて行われました。
本研究成果は、米国科学誌「Nature Communications」(10月27日付けオンライン版)に公表されました。
図:哺乳類におけるRQCの分子機構モデル
哺乳類において衝突リボソームが形成されると、ZNF598が衝突を認識し、uS10をK63型ポリユビキチン化する。ヒトRQT複合体はこのK63型ポリユビキチン鎖を認識し、リボソームのサブユニット解離を行う。
詳細については、東京大学医科学研究所 のホームページをご覧ください。