DATE2022.09.23 #プレスリリース
二刀流センサーで細胞を光らせろ!
― 合成分子でタンパク質の蛍光を制御する化学遺伝学センサーの開発 ―
朱 文超(化学専攻 博士課程)
竹内 志織(化学専攻 修士課程)
今井 渉世(理学部 化学科4年 )
寺井 琢也(化学専攻 特任准教授 )
ロバート・アール・キャンベル(化学専攻 教授/アルバータ大学 教授)
発表のポイント
- 低分子キレーターと蛍光タンパク質を適切に組み合わせることで、カルシウムイオンとナトリウムイオンに対する新たな蛍光センサーを開発しました。
- 有機合成化学とタンパク質工学を融合した独自の設計戦略により、タンパク質のみを用いた既存のセンサーでは実現できない性質を持つセンサーが開発できるようになりました。
- 今後の更なる性能向上や検出標的の拡充により、脳機能や各種疾患のメカニズム解明などに寄与する有用な技術となることが期待されます。
発表概要
生体内におけるイオンや分子の動的挙動を可視化する蛍光バイオセンサーは、現代生物学における最も重要なツールの一つです。今回、東京大学大学院理学系研究科の朱 文超大学院生、寺井琢也特任准教授、ロバート・アール・キャンベル教授らは、緑色蛍光タンパク質(GFP)(注1)と合成低分子キレーター(注2)を組み合わせた新たなタイプの蛍光センサーを開発しました。このように化学と生物学を融合させた、いわば二刀流のようなデザインは化学遺伝学(ケミジェネティック)と呼ばれます。化学遺伝学センサー自体は従来も報告がありましたが、本研究では標的に結合する部分が合成低分子でできているため、既存のデザインよりも多くの物質を対象にできる汎用性があると考えられます。
本研究で開発されたHaloGFP-Ca1はカルシウムイオン(Ca)の結合により蛍光強度が11.3倍になり、また培養細胞中でも実際にCaセンサーとして機能することが確かめられました。今後もセンサーの性能向上や汎用性を活かした新たなセンサー開発を続けることで、脳や疾患のメカニズム解明など、生物学研究の進展への貢献が期待されます。
発表内容
蛍光バイオセンサーとは、生体内の特定の物質の濃度変化や生化学反応の進行に従ってその蛍光の強度や色を変える分子のことです。例えばCaは生体内において、セカンドメッセンジャー(注3)として重要なイオンであり、その濃度変化をモニターするための蛍光バイオセンサーが数多く開発されてきました。それらは大きく分けて、天然タンパク質を基盤とするセンサーと、合成低分子を用いたセンサーの2種類に分けられます。前者は、遺伝的にコードされているため細胞や組織の中での局在化が可能であり、指向性進化法(directed evolution)と呼ばれるタンパク質工学の手法を用いることで大きく性能を高めることができるという利点がある一方で、センサーの対象にできるイオンや分子が限られているという問題点があります。後者は、化学合成によって作られる人工分子のみで構成され、検出対象は広い一方で生体内での局在化等が困難という問題点がありました。最近ではタンパク質と合成分子を併用した化学遺伝学(chemigenetic, ケミジェネティック)なセンサーもいくつか報告されていますが、いずれも蛍光低分子を何らかのタンパク質に結合させるという設計になっており、蛍光タンパク質を用いた化学遺伝学センサーは皆無でした。
発表者らは今回、検出対象(標的)に結合する部位が「低分子」で蛍光部位が「蛍光タンパク質」という、全く新しい化学遺伝学センサーのデザインを考案・実証しました。このデザインの持つ利点として、タンパク質を用いることで局在化や指向性進化法の使用が可能であり、かつ標的結合部位が低分子であるため検出対象や汎用性が広いことが挙げられます。
研究チームはまず、Ca2+と選択的に結合する合成低分子キレーター(BAPTA)とGFPとを組み合わせたCa2+センサーの開発に取組みました。キレーターをGFPに結合させる方法として、特定の低分子(クロロアルカン)を取りこむことができるタンパク質タグとして知られるHaloTagを活用する事にしました。BAPTAをHaloTagによってGFPの発色団付近に固定することで、BAPTAへのCa2+の結合がGFPの蛍光強度を変化させると考えられます(図1)。発色団とキレーターの位置関係を最適化すべく、HaloTagの中にcpGFP((注1)参照)を挿入したタンパク質変異体を32個作成しました。またBAPTAには、HaloTagと結合できるようクロロアルカンを付加する修飾を施しました。キレーターとクロロアルカンの位置関係やリンカーの長さが異なる計10種類を合成し、それらと前述の32個のタンパク質、すなわち合計320通りの組み合わせについて、Ca2+の有無での蛍光強度変化を測定しました。その結果、最も大きな変化を示した組み合わせにおいて、2.45倍の蛍光変化が見られました。
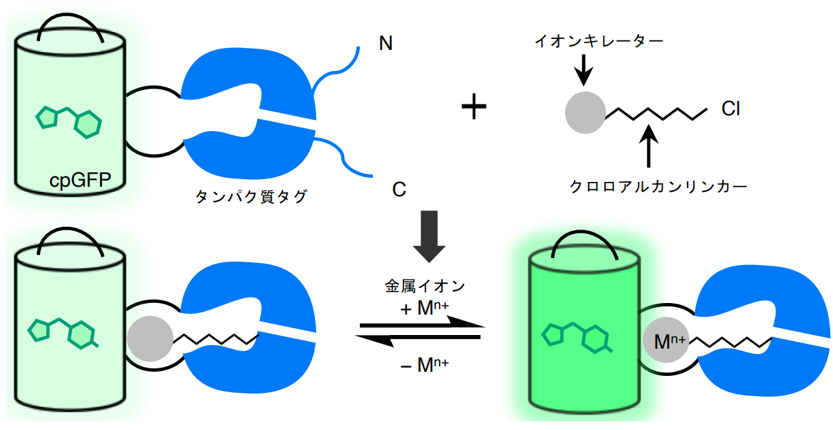
図1:本研究で開発されたセンサーデザインの模式図。合成低分子のキレーターへ金属イオンが結合することでGFPの蛍光強度が変化します。
続いてタンパク質工学の手法である指向性進化法による性能の向上を試みました。特定の残基への選択的変異導入と、遺伝子全体にランダムに変異を加える手法とを組み合わせることで、最終的に蛍光変化が11.3倍まで向上し、この変異体はHaloGFP-Ca1と名付けられました。次に、HaloGFP-Ca1をHeLa細胞(注4)と初代培養神経細胞に発現させてCa2+イメージングを行いました。いずれの細胞でもHaloGFP-Ca1がCa2+センサーとして機能することが確認され、細胞内の局在化も可能であることがわかりました(図2)。また、センサーのメカニズム解明を目的として、分子動力学(注5)を用いたシミュレーションを行いました。Ca2+が結合している場合、BAPTAのカルボキシ基とタンパク質上の残基との相互作用が減少することが示され、これが蛍光変化の要因の一つと考えられます(図3)。
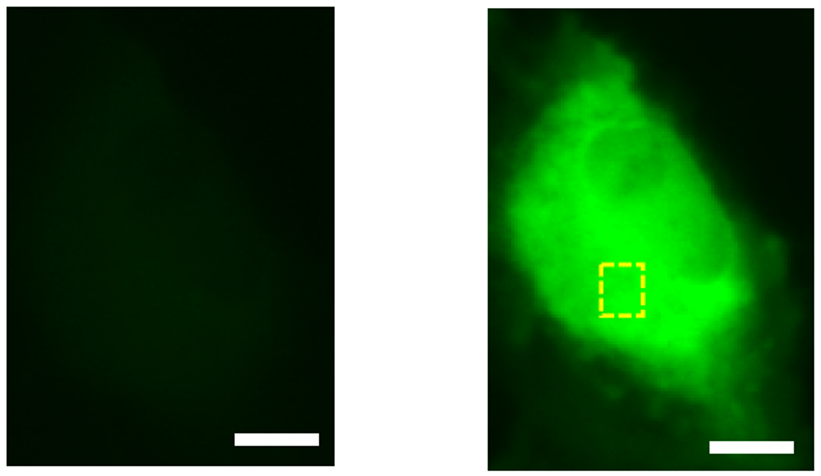
図2:HaloGFP-Ca1を用いたHeLa細胞イメージング。通常時(左)と比べ、Ca2+溶液を加えた後(右)では蛍光が強くなっています。スケールバーは10μm。

図3:シミュレーションによって予測されたHaloGFP-Ca1の立体構造。Ca2+結合前(左)と結合後(右)で図に示すような構造変化が見られると予測されます。
HaloGFP-Ca1は蛍光変化が大きいもののCa2+への親和性が低いという問題点があります。研究チームはその課題についても、指向性進化法を用いることで、細胞内の生理的なCa2+濃度で十分な応答を示す新たな変異体HaloGFP-Ca0.2を開発しました。また、本デザインの利点である汎用性を示すために、生体内で重要な機能を持つ別の金属イオンであるナトリウムイオン(Na+)に対するセンサー開発も行いました。HaloGFP-Ca1と同様の手順でcpGFPをHaloTagに挿入し、BAPTAの代わりにNa+のキレーターであるクラウンエーテルを用いました。HaloGFP-Ca1と同じようにタンパク質+リガンドの各組合せを評価し、その後指向性進化法による性能の向上を図ったところ、Na+の結合によりΔR/R0(注6)= 286%を示すHaloGFP-Na0.5の開発に成功し、センサーの設計手法がCa2+以外にも応用可能であることが示されました。
今後の課題として、他のイオンや生体内分子を標的とするセンサーの開発や、より細胞実験に適した波長を持つ赤色蛍光タンパク質(RFP)を使用したセンサー開発などが挙げられます。このような標的の充実と性能の向上を続けることで、従来の蛍光センサーにとって代わる新たな蛍光センサーが数多く生み出される事が期待されます。蛍光センサーは現在、細胞内で起こる複雑な反応を可視化するために欠かせないツールとなっています。従来のセンサーの欠点を克服した新たなセンサーの登場により、脳の仕組みや疾患のメカニズムなど、まだわかっていない点の多い生物学の研究がより推し進められていくでしょう。
本研究は日本学術振興会科学研究費助成事業(19H05633、Robert E. Campbell; 18H02103 、21H00273、寺井琢也)などの支援を受けて行われました。
本研究の主な構成員:
| 朱 文超 | 東京大学大学院理学系研究科 化学専攻 博士課程 |
| 竹内 志織 | 東京大学大学院理学系研究科 化学専攻 修士課程 |
| 今井 渉世 | 東京大学理学部 化学科4年 |
| 寺田 透 | 東京大学大学院農学生命科学研究科 応用生命工学専攻 准教授 |
| 上田 卓見 | 東京大学大学院薬学系研究科 薬科学専攻 准教授 |
| 那須 雄介 | 東京大学大学院理学系研究科 化学専攻 助教 |
| 寺井 琢也 | 東京大学大学院理学系研究科 化学専攻 特任准教授 |
| ロバート・アール・キャンベル | 東京大学大学院理学系研究科 化学専攻 教授/アルバータ大学 化学科 教授) |
発表雑誌
-
雑誌名 Nature Chemical Biology 論文タイトル Chemigenetic indicators based on synthetic chelators and green fluorescent protein 著者 Wenchao Zhu , Shiori Takeuchi , Shosei Imai , Tohru Terada , Takumi Ueda , Yusuke Nasu , Takuya Terai* & Robert Campbell* DOI番号
用語解説
注1 緑色蛍光タンパク質(GFP)
1962年、下村脩博士(2008年ノーベル化学賞受賞)がオワンクラゲから単離した緑色蛍光を示すタンパク質。タンパク質中で蛍光を発する部分を発色団と言います。本研究では、蛍光変化を起こしやすいようにGFPの発色団付近に末端位置を変化させたcpGFP (circularly permuted green fluorescent protein)が用いられました。↑
注2 キレーター
特定の金属イオンと結合することのできる分子。金属と結合する部分が複数箇所あり、これにより金属イオンを強く捕捉することができます。本研究で用いられたBAPTAは、4つのカルボキシ基と2つのアミノ基、さらに2個の酸素原子でCa2+と選択的に結合できるキレーターとして知られます。またクラウンエーテルは炭素原子と酸素原子が環状につながった分子で、環の大きさに応じてNa+などさまざまなイオンを取り込むことができます。↑
注3 セカンドメッセンジャー
生体内での情報伝達において、細胞間での情報のやり取りはホルモンなどのファーストメッセンジャ―と呼ばれる分子によって行われます。しかしそれらの多くは細胞の膜を通過できないため、セカンドメッセンジャーと呼ばれる別の分子群により細胞内でのシグナル伝達が行われます。↑
注4 HeLa細胞
1951年にヒトの子宮頸がんから分離された細胞。増殖能が非常に高いことから、世界中で培養され数多くの研究で用いられています。↑
注4 分子動力学
対象を構成する全ての粒子(原子)について、その粒子が周りからどのような力を受けるかの計算を繰り返すことで、運動方程式に従って全体の動きを時々刻々と追跡するシミュレーション手法。↑
注4 ΔR/R0
GFPは、波長が約400 nmの光と500 nmの光の2種類によって蛍光を起こすことができます。400 nmの光による蛍光と500 nmの光による蛍光の強度比をRとし、Rの値のターゲット結合前後での変化割合を示すのがΔR/R0です。↑


