DATE2021.06.01 #プレスリリース
安定でエコな心臓収縮を実現する仕組みを
心臓のタンパク質、心筋ミオシンから発見
茅 元司(物理学専攻 助教)
樋口 秀男(物理学専攻 教授)
黄 勇太(株式会社エリアル、研究当時:物理学専攻 博士課程3年)
発表のポイント
- 心臓収縮では、安定した血液の拍出とその後に続く迅速な弛緩が重要であり、その分子機構を初めて明らかにした。
- アミノ酸組成が似た骨格筋(速筋)ミオシン(注1)と比較することで、心筋ミオシンが心臓機能に特化したユニークな分子特性を持ち、協同的に機能していることを初めて示した。
- 心筋症は心筋ミオシンの遺伝子変異に由来するものが多く、心筋症発症機構の解明や治療薬の開発、また遺伝子が同じ姿勢筋(遅筋)の収縮機構の解明に繋がることが期待される。
発表概要
私たちが生きていく上で大切な心臓の収縮は、心筋ミオシンによって担われています。その分子の構造は骨格筋ミオシンと似ていることから、心臓は骨格筋と似た仕組みで収縮していると考えられてきました。しかし、骨格筋の収縮とは大きく異なり、心臓の収縮には強く安定した収縮とそれに続く迅速な弛緩による周期的な血液の拍出が求められます(図1)。
そこで東京大学大学院理学系研究科物理学専攻の茅助教らは、ミオシン15分子程度が集合したミオシンフィラメントの発する力やミオシン1分子の構造変化ダイナミクスを、光ピンセットを用いて計測し、心筋ミオシンと速筋ミオシンの結果を比較しました(図2、 3)。心筋ミオシンは、収縮する方向への構造変化(パワーストローク)と逆向きの構造変化(リバースストローク)を起こし、その頻度が負荷の増加に依存して増えることを1分子レベルで初めて示しました。さらにシミュレーションモデル解析から(図4)、このリバースストローク特性は、心臓機能で重要な安定した収縮力とその後の迅速な弛緩や、ATP(注2)の消費を抑えるエコな収縮を実現する心臓機能に特化した心筋ミオシン特有の分子機能であることがわかりました。
心筋ミオシンの変異は肥大型心筋症の主な原因の1つであることから、こうした成果が心筋症発症の解明や治療薬の開発に役立つと期待しています。
発表内容
1. 研究の背景・先行研究における問題点
心臓が正常に機能することは我々が生きていく上で最も重要なことです。今回、その心臓収縮を担っているタンパク質である心筋βミオシン(以後、心筋ミオシン)の分子特性に着目して研究しました(図1a)。私たちはこれまで骨格筋の収縮を担う速筋ミオシンの研究をしてきましたが、そのアミノ酸組成の8−9割は心筋ミオシンと同一です。タンパク質の構造が似ているゆえ、多くの研究者が心筋ミオシンの分子特性は骨格筋ミオシンと似ていると考えてきました。しかし、心臓では強い収縮を一定時間保つことにより血液の拍出量を上げる機能(図1b、①)と、その後に続く迅速な弛緩によって血圧を一気に下げる機能(図1b、②)が求められます。これは速筋に求められる大きな力と速い収縮速度を優先する機能とは大きく異なります。そこで私たちは、速筋ミオシンと比較することで、心筋ミオシンに隠された特有の分子機能が判明し、これが心臓に特化した仕組みであると考えました。
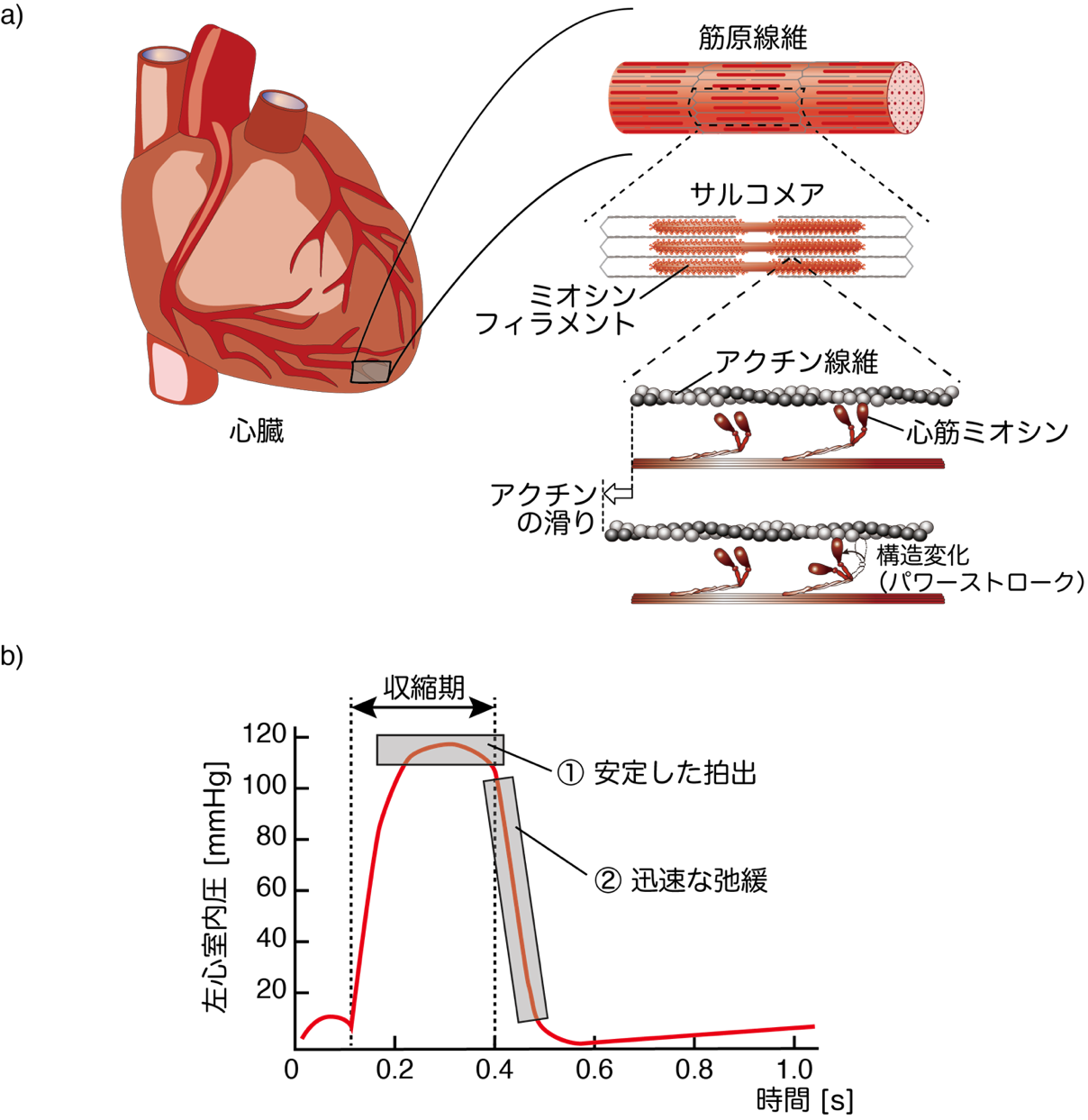
図1:a)心臓の階層的な構造。心臓を構成している線維、筋原線維の中にある周期構造、サルコメア内中央には、心筋ミオシン300分子が集合したミオシンフィラメントが位置し、アクチン線維と相互作用する。ミオシンはパワーストローク(構造変化)によりアクチンを滑らせることで収縮を生み出す。
b) 血液を送り出す左心室の典型的な血圧変化。収縮期では、安定した高い血圧を維持することでより多くの血液を拍出できる(①の部分)。一方、収縮末期から弛緩期にかけて、血圧を一気に下げることで(②の部分)、次の収縮期に向けて多くの血液を心房から心室へ一気に取り込める。
2. 研究内容
心筋ミオシン15分子程度がアクチン1本と相互作用できるフィラメントを合成し、このミオシンフィラメントがアクチンと相互作用するときの力を、光ピンセットを用いて計測しました(図2a)。その結果、心筋ミオシンフィラメントは骨格筋ミオシンフィラメントより2倍程度の大きな力を出し(図2b)、また頻繁に収縮方向とは逆向きに力が減少するバックステップが観測されました(図2c、矢じり)。
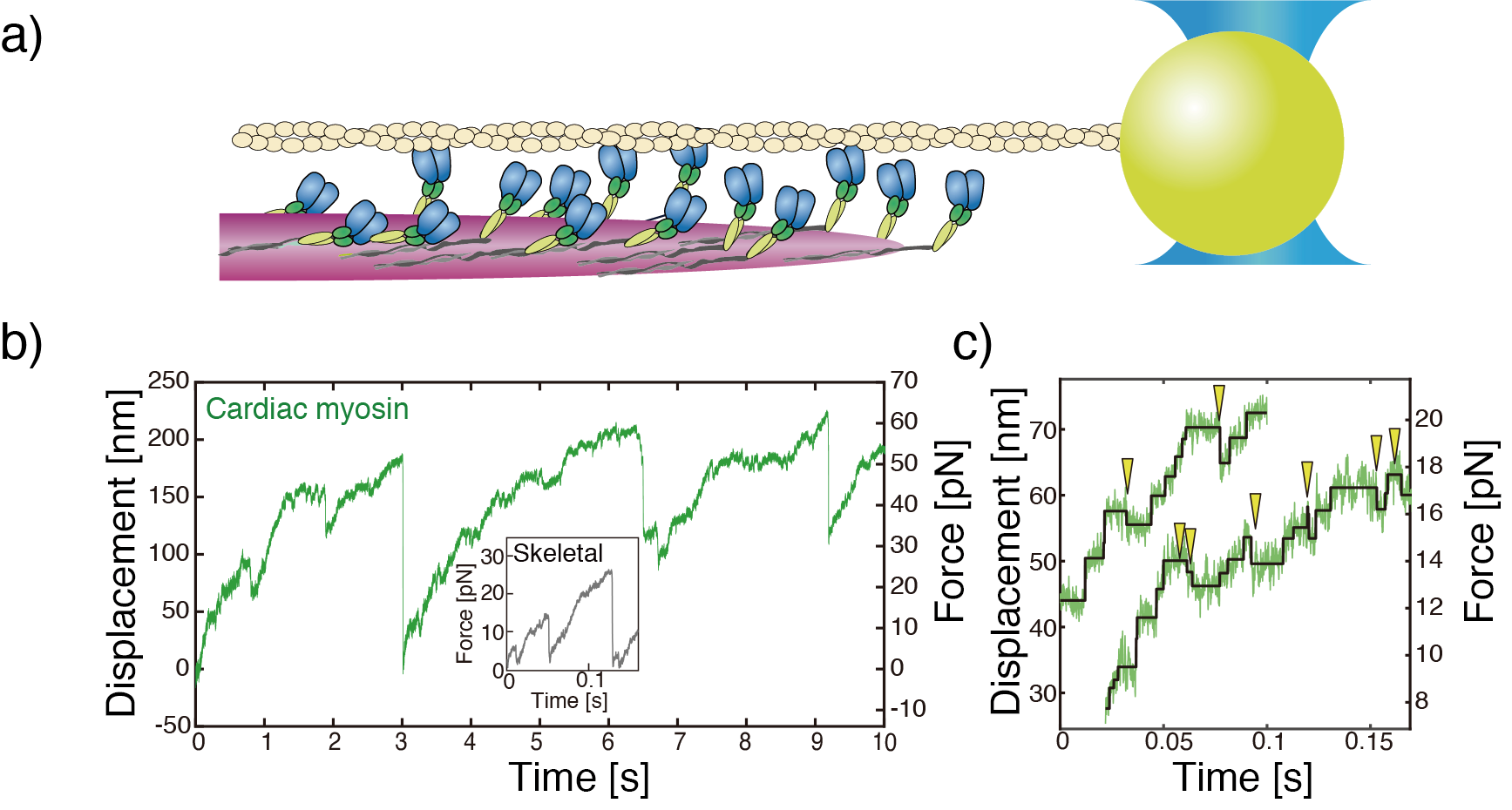
図2:a) ミオシンフィラメントの力計測。アクチンにビーズ(直径400 nm)を結合させて、集光させたレーザーでトラップする。ミオシンフィラメントによる相互作用によりアクチンが引っ張られてビーズが変位し、比例して負荷が増加する。
b)典型的なビーズの変位波形。変位ゼロがレーザーの中心位置。緑色が心筋ミオシンフィラメントの力波形で、灰色が速筋フィラメントの力波形。心筋ミオシンフィラメントの方が2倍ほど大きな力をだす。
c) 心筋ミオシンフィラメント力波形の拡大図。黄色の矢じりが示したところで、収縮方向とは逆向きに力が減少するバックステップは起きている。
この心筋ミオシン集団にユニークな力発生の分子機構を検証するため、ミオシン1分子を単離して、光ピンセットを用いてアクチンと相互作用時のミオシンを引っ張り、その時の構造変化のダイナミクスを評価しました(図3a)。その結果、速筋ミオシンは負荷に屈することなく、収縮する方向にアクチンを滑らせる構造変化(パワーストローク)を起こし、主に1つの構造状態に分布していることがわかりました(図3b、下段①の位置)。一方、心筋ミオシンは3つの構造状態に分布し(図3b、上段①〜③の位置)、これらの構造状態間をパワーストロークと、その逆向きの構造変化であるリバースストロークを起こすことで遷移していることが判明しました(図3c)。
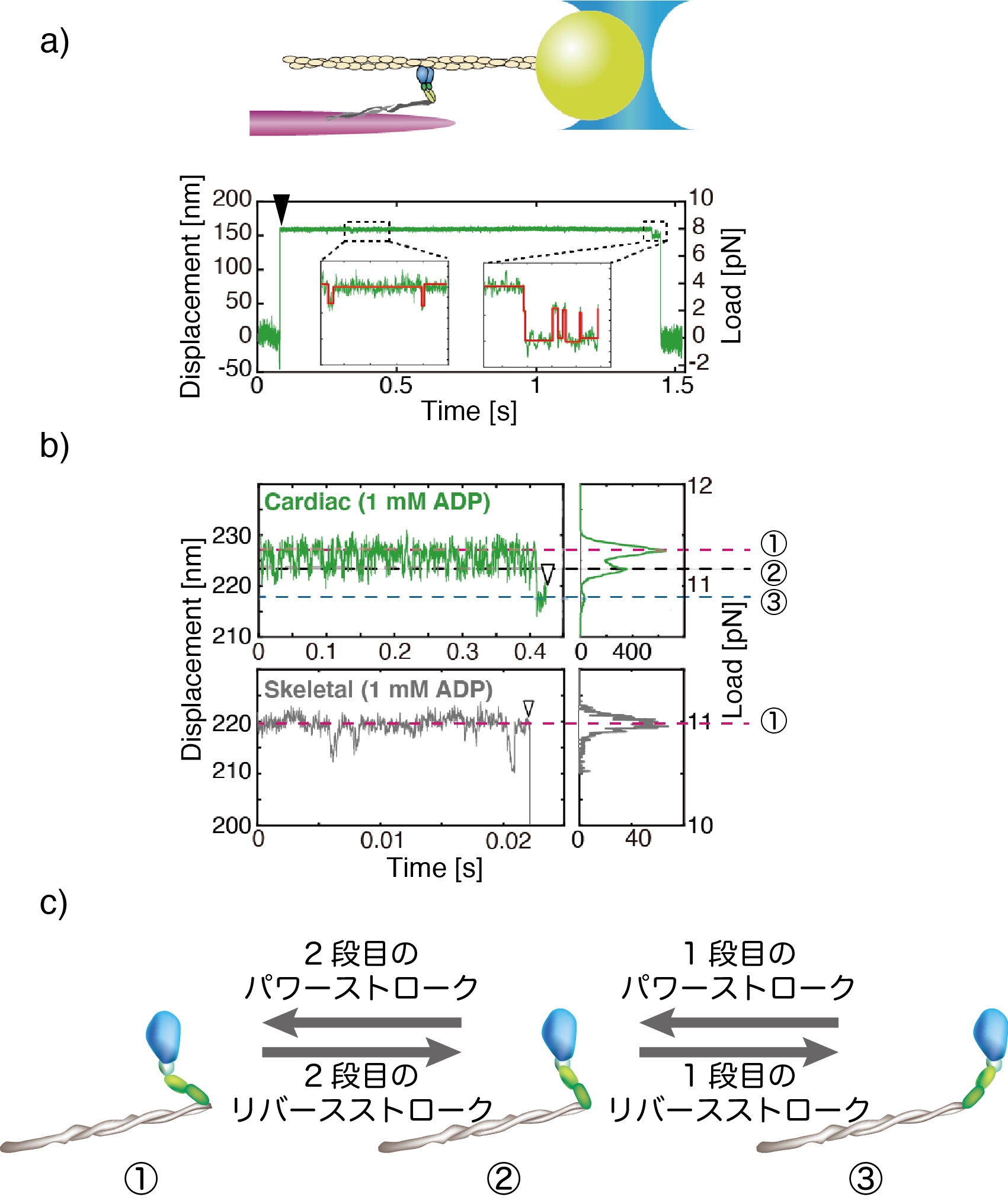
図3:a) ミオシン1分子の構造変化計測。単離したミオシン1分子にアクチンを結合させて、光ピンセットで引っ張り、ミオシンに負荷をかける(下のプロットにて黒い矢じりが示すところで、ビーズの変位が急激に起きている部分)。負荷を印加した状態のミオシンの構造変化をビーズの変位から検出する。
b) 心筋ミオシン(緑)と速筋ミオシン(灰色)における構造変化。心筋ミオシンの変位波形のヒストグラムには3つのピークが見られ、3つの構造状態①、②、③間を遷移することを示している。一方、骨格筋ミオシンには1つのピーク(構造状態①)のみで、この構造状態に主に分布する。
c) 心筋ミオシンの3つの構造状態。構造③から①への遷移は、2段階のパワーストロークにより収縮方向に動く。構造①から③への遷移は、2段階のリバースストロークにより収縮方向と逆向きの動きとなる。
そこで、シミュレーションモデルを構築し、ミオシンフィラメントの力計測で観測された心筋ミオシンフィラメントの力発生や心臓機能に関して、リバースストロークが与える影響を検証しました。シミュレーションでは、心筋ミオシンの結果に基づきリバースストロークするモデル(HRSモデル)とリバースストロークしないモデル(LRSモデル)を用意し比較しました。その結果から、心筋ミオシンは負荷の増加に依存してリバースストロークを頻繁に起こすことにより、より多くの分子がアクチンと結合して大きな力を長時間維持できること(図4b、①の部分)、またその後にリバースストローク→アクチンからの解離という一連の反応を分子間で連鎖的に起こすことで、一気に力を低下させることが分かりました(図4b、②の部分)。さらにリバースストロークは、ミオシンのATP加水分解サイクルの進行を抑えるため、ATPエネルギーの消費率を抑える効果があります(図4c)。
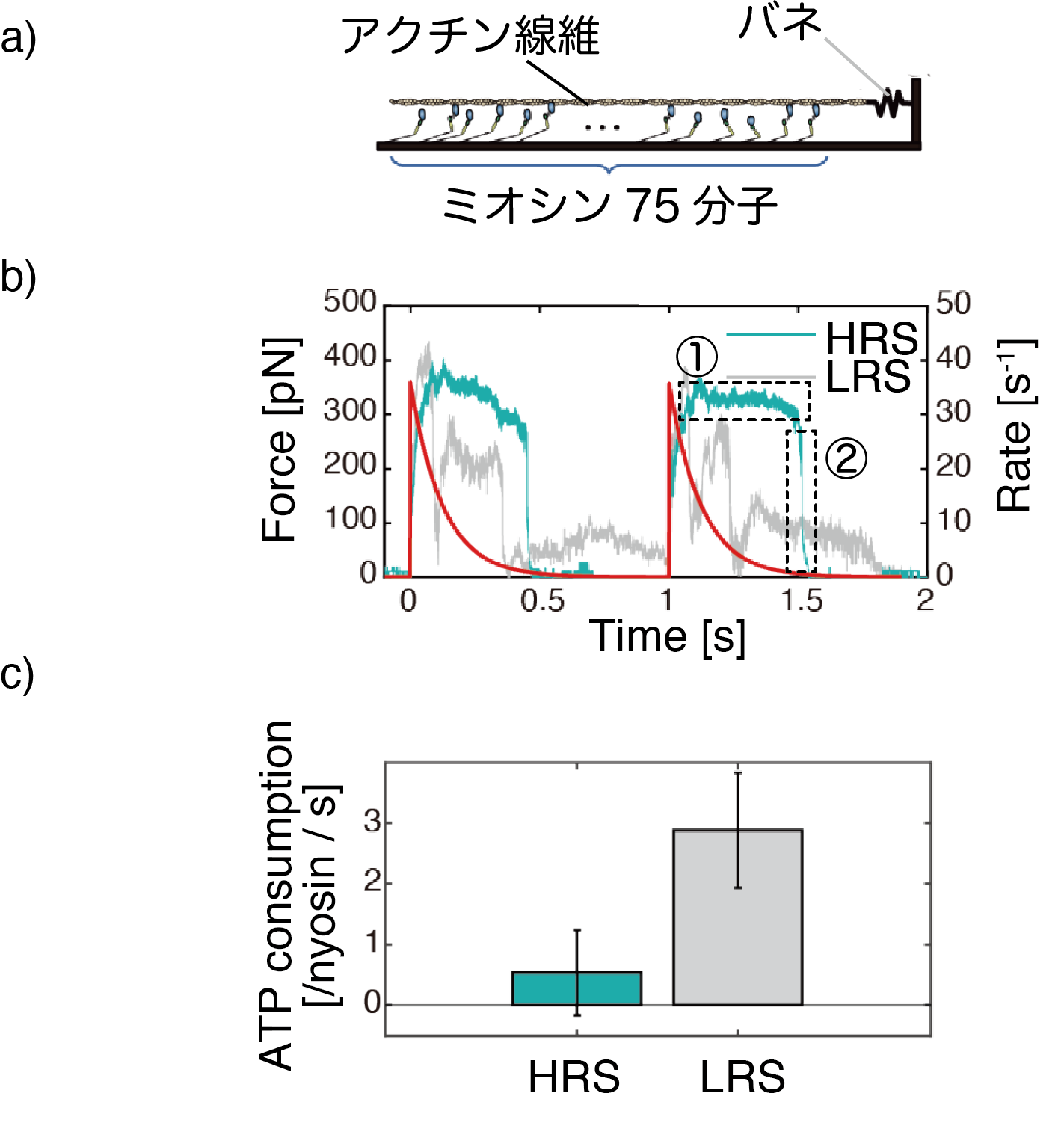
図4:a) サルコメア内における力発生のシミュレーション。サルコメア内では75分子程度がアクチン線維1本と相互作用するので、この状態をモデル化した。アクチン線維に作用する力は、アクチンに取り付けたバネの伸びから算出した。
b) シミュレーションにより計算されたアクチン1本に作用する力波形。赤い線は、心臓内で周期的な収縮と弛緩を生む周期的なカルシウム濃度変化を示す。リバースストロークをするモデル(HRS、緑)の波形は、左心室の血圧波形(図1a)同様に、安定した力発生(点線エリア①)が見られ、その後は急峻に力が下がってゼロになっている(点線エリア②)。一方、リバースストロークしにくいモデル(LRS、灰色)では、安定した力発生が見られず、また力がゼロにならない。
c)ATPの消費率の比較。ミオシン1分子の1秒あたりの消費ATP分子数は、パワーストロークするモデル(HRS)の方がパワーストロークしないモデル(LRS)より圧倒的に低いことがわかる。
以上から、リバースストロークという構造変化は、速筋ミオシンにはあまり表出しない心筋ミオシンに特徴的なものであり、この特性が分子集団の力発生と弛緩を協同的に起こし、心臓においては安定でエコな収縮を作り出す重要な鍵になっていることが解明されました。
4. 社会的意義・今後の予定
肥大型心筋症(Hypertrophic Cardio Myopathy: HCM)は突然死の原因疾患の一つであり、日本人の有病率は500人に1人ともいわれる難病です。この原因は主に収縮タンパク質の遺伝子変異に由来し、数百の変異が方向されていますが、そのうちの半分は心筋ミオシンに関わるものです。それゆえ、今回の研究成果は、HCM発症の分子機構の解明や、HCM治療に向けた新薬の効果を評価することに大きく役立つと考えられます。また骨格筋の中でも姿勢筋と知られている遅筋のミオシン遺伝子は心筋ミオシンと同じなので、姿勢筋は心臓同様に「安定でエコな収縮」をして長い時間に渡り体幹を支え、また安定した2足歩行を可能にしているのかもしれません。こうした姿勢筋の収縮の仕組みも見えてきたので、今後は、遅筋と心筋ミオシンを比較すること、また心筋ミオシンと骨格筋ミオシンにおける僅かなアミノ酸組成の違いが、ミオシン分子の構造変化の特性をどのように変えるのか検証することを進めて行きたいと考えています。
発表雑誌
-
雑誌名 Proceedings of the National Academy of Sciences of the United States of America (PNAS)論文タイトル A reverse stroke characterizes the force generation of cardiac myofilaments, leading to an understanding of heart function.著者 Yongtae Hwang, Takumi Washio, Toshiaki Hisada, Hideo Higuchi* and Motoshi Kaya*DOI番号 論文URL https://www.pnas.org/content/118/23/e2011659118
用語解説
注1 ミオシン
ATPを加水分解して得られる化学エネルギーの一部を使って、アクチン上を運動するタンパク質です。特に今回対象とした心筋ミオシンと骨格筋ミオシンは、細胞内では300分子程度が集まってミオシンフィラメントを作り,アクチン線維を滑らせます(図1a)。 ↑注2 ATP
アデノシン三リン酸と呼ばれ、アデノシンという物質に3つのリン酸基が結合しています。ATPが加水分解すると、ひとつのリン酸基がはずれてADP(アデノシン二リン酸)になり、その際に化学エネルギー(80~120×10-21 Nm)を放出し、筋収縮のエネルギー源となります。↑


