20代、毒の合成に没頭
私たちの世界は118種類の原子からできており、たくさんの原子同士がさまざまな様式で結びつき、多種多様な分子となって存在している。これまでに1億を超える分子が知られているが、存在しうる分子の種類は星の数ほどあり、その数は日々増えていくのだ、大栗教授のような化学者の手によって。
「地球上どころか宇宙にもいまだ存在していない、世界を変えるような力を持つ分子があるかもしれない。そういった分子を想い描いて設計し、自分たちの手で創り出せること。それが化学の魅力であり、圧倒的な強みですね」
実際に大栗は本郷のラボでそれにチャレンジしている。
「新しい分子は無限に作り出すことができます。近い将来、人類に役立つ、世界を変える分子のゴールドラッシュが訪れるかもしれないと思っています」
埼玉県所沢市で育ち、現在はトトロの森となった雑木林での昆虫採集、ため池での魚釣りが大好きだった大栗少年は、本人曰く、「県立川越高校から東北大学の理学部化学科に進学しましたが、気がつけば大学院でも魚に関することに手を染めていました」。熱帯の魚介類に蓄積される魚毒シガトキシンの化学合成である。シガトキシンは、海産物食中毒シガテラの原因毒で、その毒性はフグ毒の100倍以上という。
「東北大学で恩師の平間正博教授から、このシガトキシンの分子構造を決定しつつ、化学合成に挑戦するチャンスをいただきました。いざ始めるとたいへん手強いので、真剣になればなるほど面白くなって、のめりこみましたね。修士課程では、アカデミック研究者になる将来を想定していませんでしたが、結果的には20代をすべてこれに賭けてしまいました」
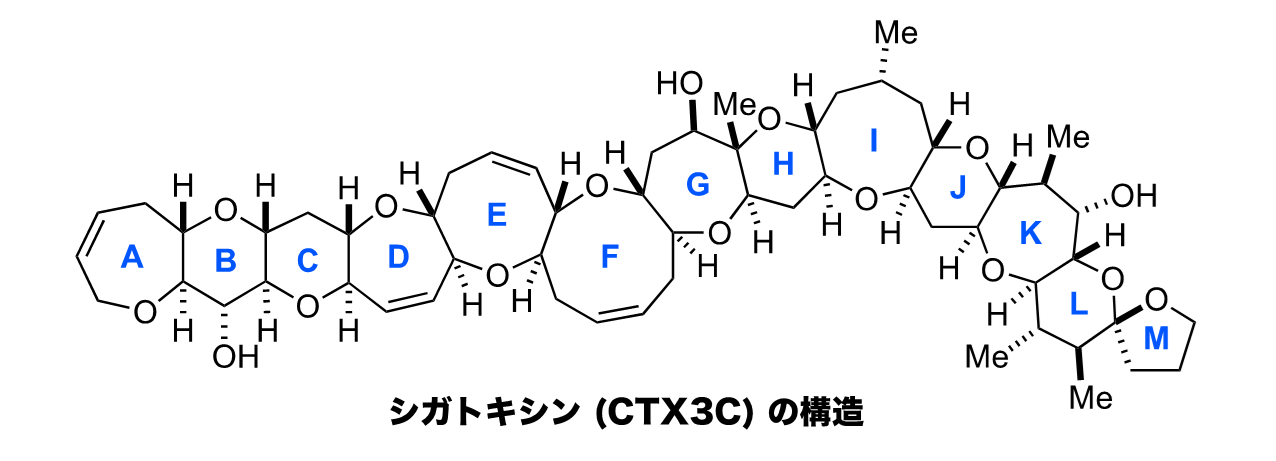
大栗らが挑んだのは、シガトキシンの全合成だった。全合成とは最小単位の出発原料から天然物を人工的に化学合成することである。つまり、自然の助けを借りずに、フラスコの中で有機分子を作り出すのだ。しかも、シガトキシンは13個のエーテル環が梯子状に連なった構造を持つ極めて複雑で巨大な分子であったからその壁はすこぶる高い。もちろん、全合成を成し遂げられれば世界初の快挙となる。そして──。
「平間研究室では、大石徹先生注1、井上将行さん注2ら10人以上の仲間と10年をかけて、ついに全合成に漕ぎ着けることができました。そして、我々が編み出した合成法を駆使して、シガトキシン (CTX3C) を認識するモノクローナル抗体を調製し、毒素の検定法も開発できました。遊びたい盛りの我々でしたが、庄司満さん注3ら後輩も一緒になって、朝から晩まで試行錯誤を繰り返し、巨大毒素の化学合成に打ち込みました。自分たちが考えた合成ルートで複雑な分子を組み上げていく、その日々の検討が純粋に楽しかったですね。ですから学生さんたちには、周囲にどう言われようとも、自分が楽しいと思えたことはどんどんやってしまったらいいと伝えたいです。自分の興味のおもむくままに20代を思いっきり突っ走って欲しい!」
実際に“思いっきり突っ走った”この経験が大栗の原点となる。
分子の骨格を創り出す。
研究者としての人生を歩み始めた大栗は、やがてハーバード大学へと旅立つ。
「天然物の化学合成を専門としていた化学者であるスチュアート・シュライバー教授が、人体に存在するすべてのタンパク質一つ一つの機能を制御する有機化合物群を創り出す挑戦を開始していました。分子の多様性を作り出す合成化学が未来の扉を開く鍵となることを提唱しているシュライバー先生に、僕はとても共鳴しました」
シュライバー教授はケミカルバイオロジーという新しい分野を開拓したことでも知られており、ノーベル賞の呼び声も高い。
有機化合物の多くは、主に炭素原子が結合して形作られる分子骨格を持っている。「分子骨格(あるいは単に骨格とも言う)」は、人間で言えば背骨、自動車ならシャーシとエンジンにあたるかもしれない。この骨格に酸素・窒素・硫黄といった他の原子がさまざまな様式で結びつくことで、いろいろな特性を持った膨大な種類の有機化合物が生み出される。医薬品や農薬、ファインケミカルなどの開発において、適切な分子骨格を入手できれば、その後の化学合成は比較的容易に行うことができる。
「ハーバードでは、4種類のシンプルな出発原料を繋ぎ合わせながら、天然物のような複雑な分子骨格群を短い工程数で創り出す化学合成法を考案して、独力で実現しました。この研究では、あこがれのシュライバー先生と二人だけの論文を出すことができました」と大栗は嬉しそうに笑みを浮かべた。
生合成を摸倣し、拡張する合成化学
シュライバー先生の引き止めに後ろ髪を引かれつつも、わずか1年で日本に戻ったのは、欧米の科学者とは異なるオリエンタルなアプローチ、大栗の言葉で言えば「日本の天然物化学の香りがするというか、自然と調和する合成化学」を追求したいという想いが湧き上がってきたからだった。
「欧米の研究者は合理的なアプローチが得意なので、構造の多様性を拡大するのに適した化学反応を採用して、多種類の化合物を効率よく合成する展開となると予想しました。一方僕は、個性豊かな天然物を産生する植物や菌類の生合成プロセスを模倣しつつ、自然界には存在しない分子を合成化学の力で創り出せないかと思っていました。化学の力だけでは一握りの研究室でしか合成できなかった分子骨格も、藻類や菌類を“共同研究者”にして、誰でも簡単に作り出せるようにしたい! そういう化学を開拓すれば欧米とは違うアプローチで、日本の強みを出せるのではないかと妄想してきました」
たとえば、シガトキシンを作り出すのは渦鞭毛藻(うずべんもうそう)というプランクトンである。珊瑚礁に棲息するこの藻類は、シガトキシン類を作り出すことに関しては、「我々よりも圧倒的に優れた“化学者”なわけです」と大栗は言うのだ。
生合成とは、この渦鞭毛藻がシガトキシンを作るように、生物が自らの体内でさまざまな酵素(触媒)を用いて天然有機化合物を作り出すことだが、大栗はこういった生物の体内で起きている一連の化学反応(生合成経路)を解き明かす研究の重要性や、有用な天然物群を人工的に合成するアプローチの将来性を肌で感じていた。
「その想いが通じて、北海道大学理学部化学科の及川英秋先生に助教授として採用していただき、札幌での研究生活が始まりました。及川研究室では、多様な天然物の生合成について、基礎から最先端までを学ぶことができました」
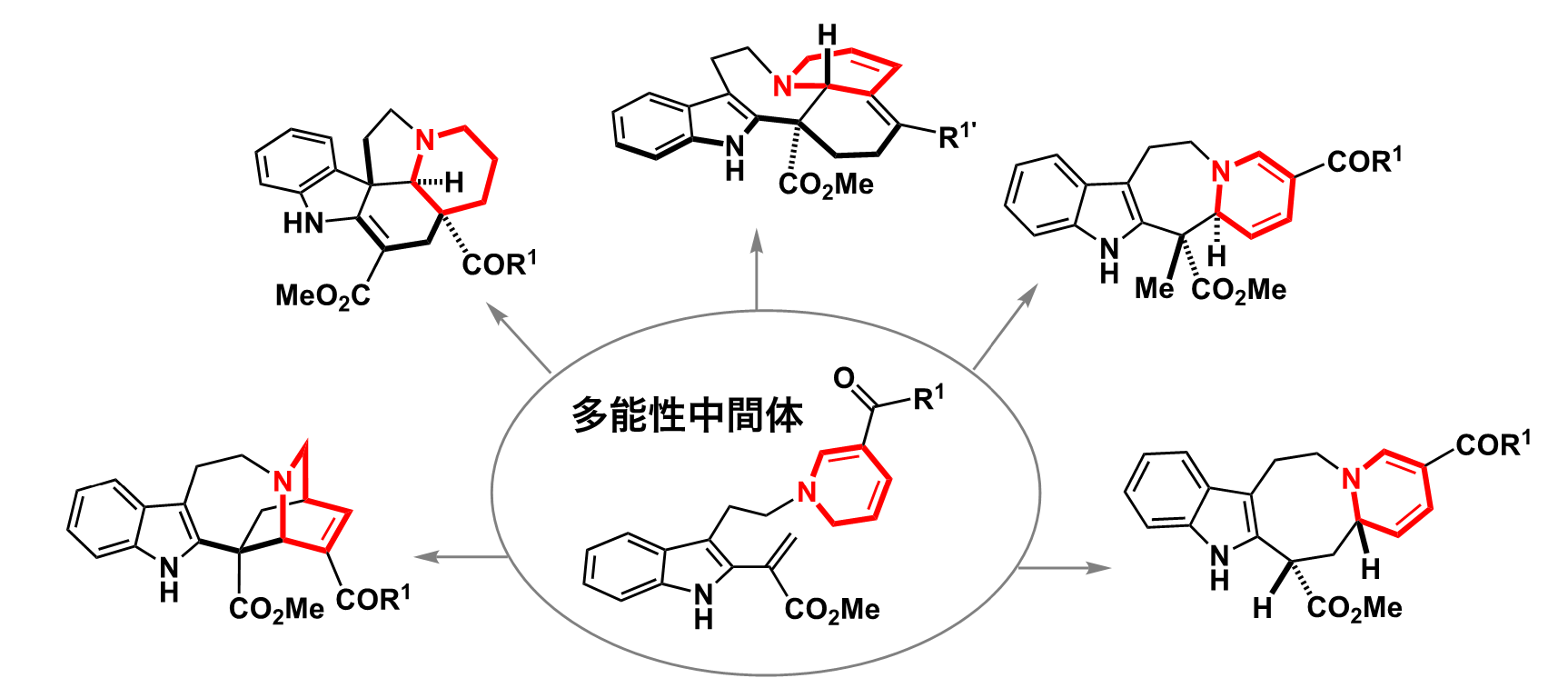
北海道大学では、ニチニチソウ(日々草)が作り出すアルカロイド(窒素を含む天然物)に着目したアプローチを大栗は成功させた。ニチニチソウなどの植物は、多彩な化学反応性を秘めた共通の鍵中間体(合成経路の途中の化合物)を発生させ、この中間体にさまざまな酵素群が作用し、多様な分子骨格を生み出すという生合成戦略をとっている。ただし、この鍵中間体はとても不安定で、植物から取り出したり、化学合成する試みもうまくいってはいなかった。大栗と溝口玄樹さん注4は、この生合成の鍵中間体を摸倣しつつ、実験室で安定的に取り扱いながらも、さまざまな分子骨格へ分化していけるような“多能性中間体”を設計し、手早く化学合成した。そしてフラスコ内に発生させたこの多能性中間体を多様な条件で反応させ、5系統の分子骨格群を作り分けることに成功したのだ。これにより、ニチニチソウの生合成プロセスをお手本としつつ、目の前のフラスコに対して、合理的な検討や遊び心のある実験を試し、誰も手にしたことのない創薬候補化合物群を簡単に、そして自在に創り出せるという確かな手応えをつかんだのである。
酵素ハイブリッド合成を開拓
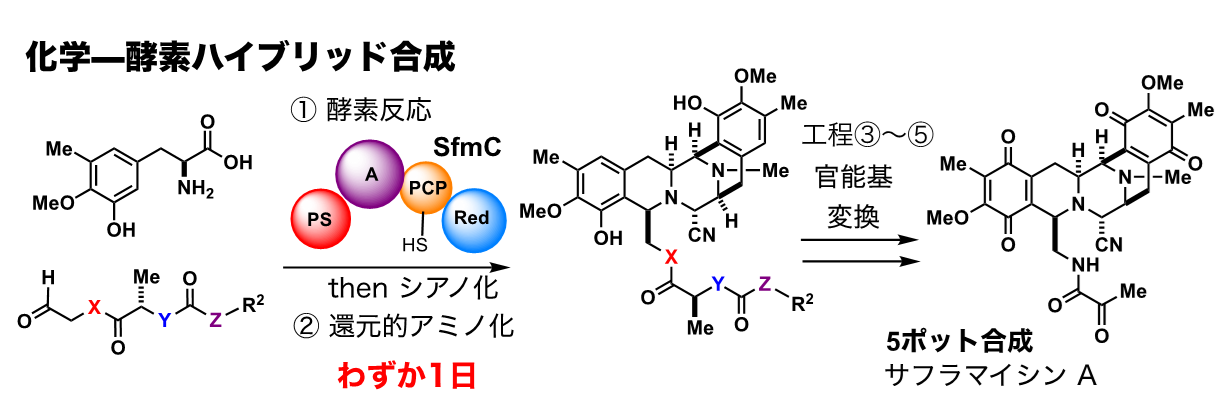
東京農工大学の教授として独立した大栗は、生合成酵素を活用して複雑な分子骨格を一挙に組み上げる合成法を開拓した。サフラマイシン類の化学―酵素ハイブリッドプロセスの開発である。
サフラマイシンやエクテナサイジンは共通の分子骨格を持ち、いずれも強力な制ガン活性を発揮する天然物である。海洋生物ホヤから単離されたエクテナサイジン類は難治性ガンの治療薬として臨床応用されているが、化学合成に20工程以上が必要で、新しい誘導体を作り出すのも困難な状況だ。北大の及川研究室で積み重ねたサフラマイシンの生合成研究を土台として、大栗と当時大学院生だった谷藤涼さん注5は、化学合成した基質(原料)に大腸菌で発現した生合成酵素を作用させて、共通の分子骨格を一挙に組み上げることにチャレンジした。
「この生合成酵素は巨大なタンパク質で、分子量(分子を構成する原子の原子量の和)が16万もあります。分子量が500程度しかないサフラマイシンを生合成するのに、生物はわざわざ巨大な酵素を用意しています。おそらく、小さくても種の存続に重要な骨格を精巧な7連続の化学反応でしっかりと作り上げるためなのですね」
谷藤は大腸菌で発現した巨大な酵素を朝早くから精製し、合成した基質群の酵素による変換反応を粘り強く繰り返した。酵素変換が進行しない、お先真っ暗の日々が続いたが、博士課程に進学した谷藤の鋭い観察眼によってその突破口は開かれた。さまざまな改良を加えて幾多の課題を解決し、ついにわずか1日で複雑な分子骨格を一挙に合成できるようになったのである。
「さらにそこから2〜3工程の変換を経て、天然物ジョルナマイシンやサフラマイシンの全合成にも成功しました。医薬品のシード化合物として重要で、かなり複雑な構造の分子骨格を人工的な生合成プロセスであっと言う間に組み上げる化学–酵素ハイブリッド合成。このブレークスルーで“世界の谷藤”になりましたね」と大栗は顔をほころばせる。
未踏の分子を圧倒的に少ない合成工程で創り出す
このサフラマイシン類のハイブリッド合成と並行して、大栗はさまざまなプロジェクトを企てている。その一つが、マラリア治療に革新をもたらしたアルテミシニンという天然物の分子骨格を改変し、格段に短い工程で合成するプロセスの開発である。アルテミシニンは漢方薬の有効成分であり、中国の女性研究者トゥー・ユーユー博士はこのアルテミシニンを用いたマラリア治療法の開発で2015年のノーベル生理学・医学賞を受賞した。ヨモギ属の植物がアルテミシニンを生合成するので、現在ではこの植物の生合成遺伝子を組み込んだ酵母を培養して、生合成中間体を大量に生産した後、6工程の化学合成を経てアルテミシニン系薬剤が供給されている。大栗はそんなアルテミシニンを、まったく違うアプローチから作り変えようとしたのだ。
「アルテミシニンの母骨格の炭素の1つを窒素に入れ替えた 6–アザ–アルテミシニンという分子を設計しました。窒素原子を骨格に組み込むことで、酵素変換に依存せざるを得なかった既存の生産プロセスとは、一線を画した合成法を編み出すことができたのです。目覚ましい治療効果を発揮する分子骨格を単純な原料からわずか4工程で作ることができます。
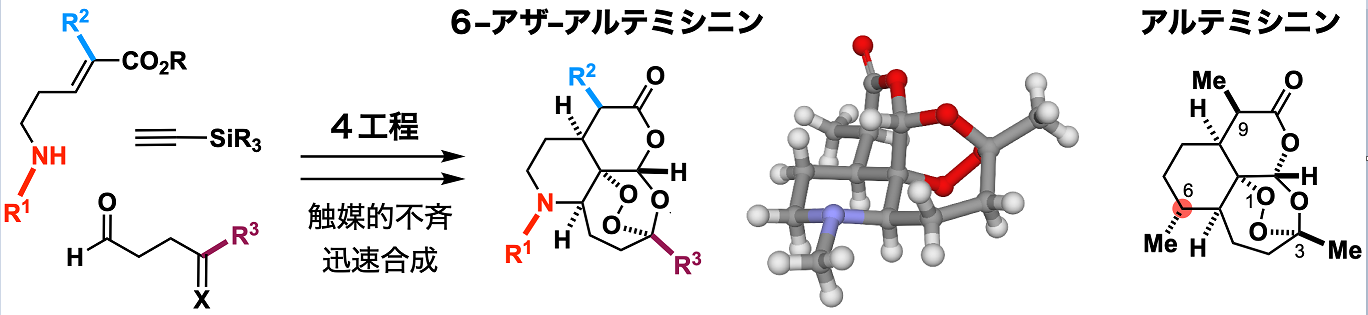
複雑な天然物の構造を単純化して合成するアプローチは以前から検討されてきましたが、天然物の構造を簡略化せずに分子骨格の元素を入れ替え、さらに機能化した分子骨格を創り出すアプローチは、ほとんど手つかずです。実際、アザ–アルテミシニンは既存のアルテミシニン系薬剤よりも優れたマラリア治療効果を示すことを実証できました。このように新しい分子骨格を想い描き、化学の力で創り出すことで、医学や薬学の新しい展開を拓く起爆剤を提供できると考えています」
基礎研究からの革新を求めて
大栗らの挑戦は、単に新しい分子を合成することではない。最先端の化学を駆使して天然物を進化させ、だれも手にしたことがない新しい分子骨格を創り出し、独自の価値を生み出す。未踏の分子資源を手早く自在に創り出す基礎研究は、次世代の医薬品・農薬候補化合物の創製に直結する。
「アルテミシニンもそうですが、複雑な構造の分子を合成して薬として開発するのはたいへんな仕事です。創薬もビジネスですから、確実に合成できるか、容易に培養できるものではないと難しいという判断になりがちです。そのため製薬企業では、天然物をベースとした創薬研究から手を引いていく傾向が30年来続いてきました。しかし、格段に優れた薬効が期待できる分子骨格群を簡単に構築し、自在に最適化できる化学合成を実現できれば、生物進化の歴史が刻み込まれた天然物を基盤とした創薬研究の合理性と未開拓のポテンシャルが見直されるはずです」
大学の研究者としての志は、生体機能性分子群を設計して合成するための新しい考え方、従前とは異なる戦略を提案する基礎研究にあると大栗は言う。自然に学んで生合成の中間体や酵素反応を活用しつつ、有機化学を駆使して自在に拡張する合成プロセスを実現する。このアプローチにのっとれば誰にでも簡単に複雑な骨格を作り出すことができ、その先にはいろいろな展開、可能性が大きく広がっていることを化学者として示すこと、大栗はこれに主眼を置いている。単に創薬候補化合物の創製にとどまらない、より社会的で誠実な取り組みと言えるかもしれない。
地上に存在しない分子を果敢に、しかも圧倒的なスピードで作り出す大栗のラボ。
「創薬の現場では、平らなパネルのような構築ブロックを組み合わせるアプローチで多種類の分子が作り出されてきました。ただ、既存の手法では、分子構造の複雑性と多様性が限定されます。一方、植物や菌類では、ものすごく長大なゲノム情報として暗号化された生合成遺伝子から巨大な酵素群を用意します。そして、多段階におよぶ手の込んだ酵素反応で複雑な凹凸の形状の分子表面を持つ天然物を生合成しています。薬の標的となるタンパク質に固有のデコボコした分子表面に高い親和性をもって相互作用をする天然物やその類縁体の化学合成は格段に難しく、手間も時間もかかるので、なかなか手が出せないというのが現状でした。僕らのラボは、こういった生体機能性分子群の複雑性と多様性を系統的にプログラムして創り出す挑戦を続けています。複雑な分子を誰でも簡単に合成できるようになれば、創薬の世界でのゲームチェンジに貢献できると思います」

意外な発見を目指して
有用な生物活性が期待される分子群の複雑性と多様性を合理的に生み出し、分子の三次元構造を自在に操ることもこの「未踏の研究領域」の一つである。想い描いた分子を意のままに合成する。それは創薬などへの貢献にとどまらず、生物の謎やメカニズムの解明につながると大栗は語る。それは大栗がもっとも力を入れているケミカルバイオロジーの研究である。その研究領域でどんな新しい発見をしてみたいかと聞くと、こんな答が返ってきた。

「それはもう『小さな分子がこれほど大きな変化を引き起こすのか!?』と誰もが想像すらしていなかったユニークな分子を創り出したいです(笑)。いいかげんに聞こえるかもしれませんが、そういうものじゃないと、インパクトがないし、“本当の発見”にならないと思いますからね」
大栗は茶目っ気たっぷりに笑った。そして最後の質問──研究は楽しいですか?
「とっても楽しいですね。見当違いや悔しい失敗を繰り返す日々ですが、研究の醍醐味を一度味わってしまうと、やめられませんね。目論見通りに進んだか? なんでこんなことが起きたのか? 目の前のフラスコが教えてくれるメッセージを受け止めて改善し、着実に前進していけます。本郷では、学生諸氏が自らの手で創り出した愛着のある分子を生体へ送り込み、細胞同士のささやきに耳を傾けて、意外な発見へ結びつけていきたいです」
注1:現・九州大学教授、注2:現・東京大学教授、注3:現・横浜薬科大学教授、注4:現・岡山大学准教授、注5:現・大栗研究室で助教を務めている
※Year of interview:2022
文/太田 稔
写真/貝塚 純一

![リガクル[rigaku-ru] Exploring Science](/ja/rigakuru/images/top/title_RIGAKURU.png)










