DATE2021.03.10 #Press Releases
肝臓-筋肉の臓器連関代謝サイクルの肥満による制御異常の解明
江上 陸(大学院新領域創成科学研究科 博士課程3年生)
小鍛治 俊也(生物科学専攻 特任助教)
幡野 敦(新潟大学大学院医歯学総合研究科 助教)
黒田 真也(生物科学専攻 教授)
発表のポイント
- 肝臓と筋肉において、野生型マウスと肥満モデルマウス間で変化した肝臓と筋肉における大規模代謝制御ネットワーク(トランスオミクスネットワーク(注1))を構築し、血液の代謝物データと統合することで、肥満における臓器間の代謝物のやりとり(臓器連関代謝サイクル(注2))の破綻のメカニズムを明らかにしました。
- 代謝物の臓器-血液間のやりとりに機能する輸送体の発現異常や、肝臓と筋肉の代謝酵素の発現異常が肥満マウスの高血糖に寄与している可能性を明らかにしました。
- 臓器連関代謝サイクルの肥満による破綻のメカニズムを網羅的に解明するトランスオミクスネットワーク解析は、肥満における高血糖症といった多臓器連関の代謝異常のメカニズム解明に役立つと考えられます。
発表概要
東京大学大学院新領域創成科学研究科の江上陸大学院生と大学院理学系研究科の小鍛治俊也特任助教、黒田真也教授、新潟大学大学院医歯学総合研究科の幡野敦助教らは、広島大学大学院総合生命科学研究科の藤井雅史助教、筑波大学医学医療系の尾崎遼准教授、土屋貴穂助教、金沢大学医薬保健学総合研究科の井上啓教授、九州大学生体防御医学研究所の中山敬一教授、久保田浩行教授、宇田新介准教授、新潟大学大学院医歯学総合研究科の松本雅記教授、東京大学大学院新領域創成科学研究科の鈴木穣教授、理化学研究所生命医科学研究センターの柚木克之チームリーダー、慶應義塾大学先端生命科学研究所の曽我朋義教授、平山明由特任講師との共同研究を行い、マウスモデルを用いた代謝制御ネットワークによる解析から、肥満による臓器連関代謝サイクルの破綻のメカニズムを大規模に明らかにしました。
肝臓や筋肉といった臓器は、体内の状態に応じて全身の代謝を適切にコントロールする代謝臓器として機能します。また体内ではこれらの代謝臓器単体だけではなく、血液を介した代謝臓器間での代謝物のやり取りが全身の代謝状態を一定に保つために機能しています。しかし肥満になると代謝臓器での適切な代謝制御が乱れ、血糖値が高くなるなどの異常がみられます。このような代謝異常に関する研究は、肝臓や筋肉などの単独の臓器についてはよく研究されてきましたが、血液を介した臓器間での代謝物のやりとりと、それらの制御機構が肥満によってどのように破綻するのかは不明でした。
今回、研究チームは、空腹時の野生型マウスと肥満マウスから肝臓と筋肉を採取し、肝臓と筋肉から取得した転写産物発現データ、タンパク質発現データ、代謝物データを用いて、野生型と肥満マウスで変化した肝臓と筋肉における大規模代謝制御ネットワークを構築しました。さらに血液の代謝物データも取得し、肝臓と筋肉のそれぞれの大規模代謝制御ネットワークと組み合わせることで、血液を介した肝臓-筋肉間の代謝物のやりとりの肥満による機能不全と、その制御異常を大規模に明らかにしました。研究グループは肝臓で糖の産生と血中への放出が増大し、一方で筋肉では糖の消費が減少したことが、肥満マウスの高血糖につながることなどを明らかにしました。
発表内容
研究の背景
全身の代謝恒常性は肝臓や筋肉のような個々の代謝臓器に加え、これらの代謝臓器間の血液を介した代謝物のやり取りである臓器連関代謝サイクルによって適切に制御されています。例えば空腹時の健常個体では、肝臓でのグルコースの産生や血中への放出が促進し、筋肉などの抹消組織において取り込まれてエネルギー源として利用されます。一方で、筋肉ではグルコースは乳酸やアラニンへと変換され肝臓へと移行し、糖の産生の新たな基質として利用されます。このような臓器連関代謝サイクルはグルコース-アラニンサイクルやグルコース-乳酸サイクル(コリ回路)として知られています。また、肥満は各臓器での適切な代謝制御を乱し、高血糖症や2型糖尿病などの全身性の代謝疾患を引き起こす病態です。これまで肝臓のような個々の代謝臓器に対する肥満の影響はよく研究されてきましたが、臓器連関代謝サイクルの制御に対する肥満の影響はほとんど明らかとされていません。
各臓器での代謝制御は転写産物やタンパク質、代謝物を含む巨大な分子ネットワークを介して行われます。近年、多くの分子を同時に測定し繋げるトランスオミクス解析の発展により、大規模な代謝分子の制御ネットワークの同定が可能となりました。本研究グループは野生型と肥満マウスの肝臓と筋肉に対してトランスオミクス解析を行い、肝臓と筋肉における肥満で変化した大規模代謝制御ネットワークを構築しました。さらに、各臓器のネットワークと血液の代謝物データを統合することで、肥満による臓器連関代謝サイクルの破綻とその制御異常のメカニズムを大規模に明らかにしました(図1)。
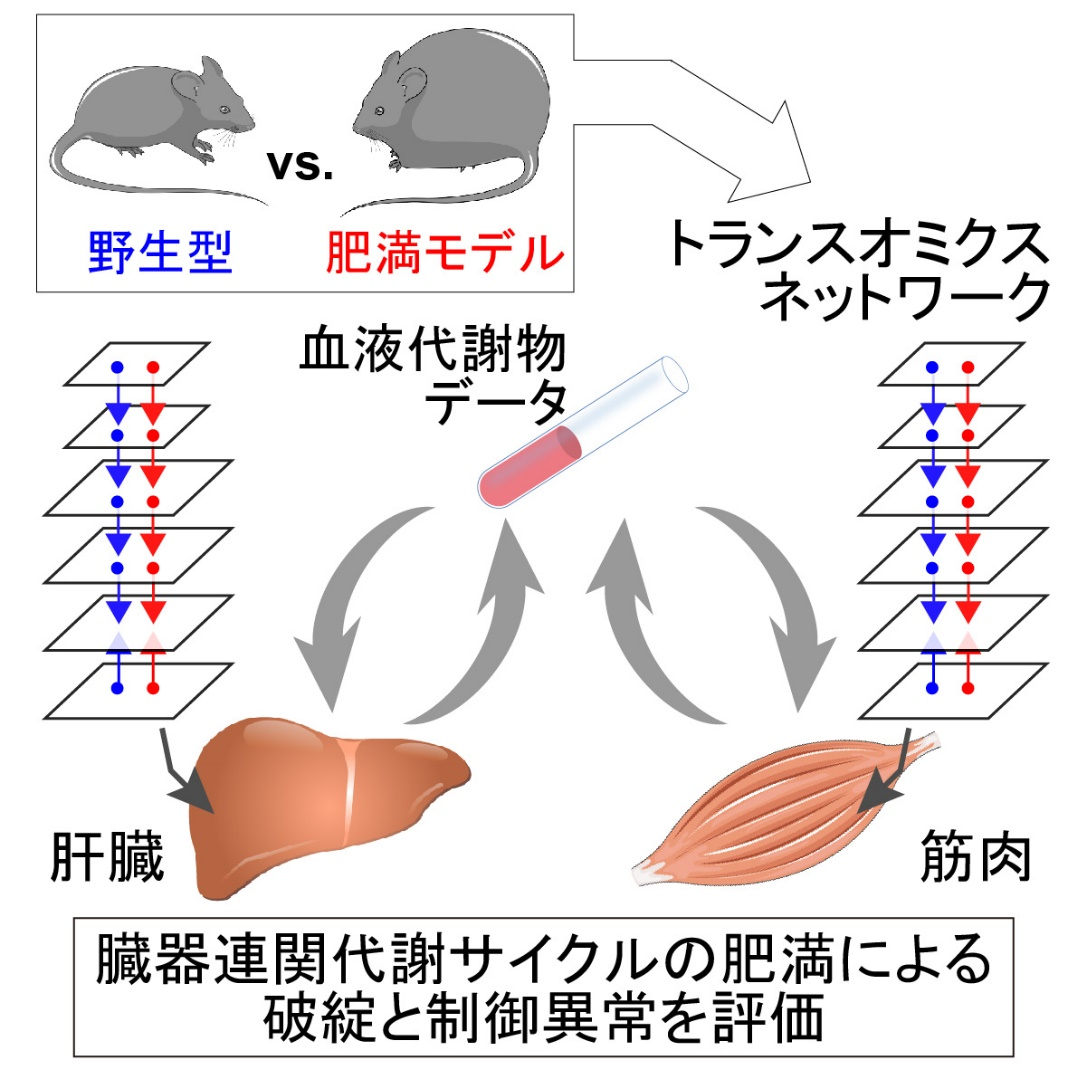
図1:研究概要図
肝臓と筋肉のそれぞれの代謝臓器について、野生型と肥満モデルマウスで変化した大規模な代謝制御ネットワーク(トランスオミクスネットワーク)を構築し、血液の代謝物データと統合することで、臓器連関代謝サイクルの肥満による破綻とその制御異常を明らかにした。
研究内容
本研究グループは16時間絶食後の野生型マウスと肥満モデルマウスであるob/obマウスの肝臓と筋肉を用いて、トランスクリプトーム解析(注3)とプロテオーム解析(注4)、メタボローム解析(注5)、リピドーム解析(注6)を実施し、転写産物やタンパク質、代謝物、脂質の量について網羅的な計測を行いました。これらの大規模データから野生型と肥満マウスの比較を行い、肥満によって増加もしくは減少した代謝酵素転写産物やタンパク質、代謝物、脂質を同定しました。さらに同定した代謝酵素遺伝子について、塩基配列を用いた手法により肥満で活性の変化した転写因子を推定しました。また、インスリンシグナル経路を対象にリン酸化が肥満によって変化した分子群の同定も行いました。次に制御経路データベースを用いて、肥満で発現が変化した代謝酵素群や代謝物によって直接制御される代謝酵素群を同定しました。さらに肝臓と筋肉について、それらの制御関係をバイオインフォマティクスの手法により統合することで肝臓と筋肉における肥満で変化した大規模な代謝制御ネットワークを構築しました。ここでは転写因子の活性によって発現制御された代謝酵素群などを明らかにしており、例えば肥満の肝臓では糖代謝や脂質代謝に関わる多くの代謝酵素の発現が増加し、これらの発現はPpargやKlf4といった転写因子によって制御されていることが示唆されました。
本研究グループは、肝臓と筋肉のそれぞれで構築した肥満で変化した代謝制御ネットワークに加えて血液の代謝物データも取得し、各臓器の代謝制御ネットワークと統合することで、肥満によって変化した臓器連関代謝サイクルの全貌を明らかにすることを試みました。本研究では空腹時の体内において代謝恒常性の中枢を担う肝臓-筋肉間の臓器連関代謝サイクルである、グルコース-アラニンやグルコース-乳酸、ケトン体代謝回路の3つのサイクルに着目しました。その結果、糖の代謝に関わるグルコース-アラニンとグルコース-乳酸回路では、(i)肝臓でのアラニンや乳酸の輸送体を介した取り込みや、それらの代謝物を基質としたグルコースの産生が増えること、(ii)筋肉での輸送体を介したグルコースの取り込みの障害や、解糖系代謝酵素の発現が減弱しグルコースの消費やアラニンの産生が減少することが明らかとなりました。このような臓器連関代謝サイクルに関わる各臓器での代謝制御の異常が肥満マウスの高血糖に寄与している可能性が考えられました。また肥満マウスのケトン体代謝サイクルでは、肝臓で産生が増大したケトン体を筋肉では取り込めず、ケトン体代謝酵素の発現も減少することなどからケトン体をエネルギー源として利用できていないことが示唆されました。
社会的意義
本研究グループは、大規模な代謝制御ネットワークの構築から、肝臓-筋肉間の臓器連関代謝サイクルの肥満による破綻のメカニズムを初めて大規模に明らかとしました。これにより、高血糖症などの肥満による全身の代謝恒常性の破綻について、代謝物の臓器間でのやりとりの制御異常という新しい側面から評価することが可能となりました。本研究は従来の単一の代謝臓器の解析では解明できなかった代謝異常のメカニズム解明を可能としますが、現状は肝臓と筋肉の二臓器間にのみ着目しています。今後は脂肪細胞や脳といった他の代謝臓器にも本解析手法を拡張していくことにより、肥満症に伴う高血糖症や2型糖尿病のような疾患の全容が明らかにされていくと考えています。
なお、本研究は、新学術領域研究(研究領域提案型)「2型糖尿病の代謝アダプテーション」(課題番号:17H06300 研究代表者:黒田真也)、上原記念生命科学財団特定研究助成「トランスオミクスによる代謝疾患のデータ駆動型解析」の一環として得られました。
発表雑誌
-
雑誌名 iScience 論文タイトル Trans-Omic Analysis Reveals Obesity-Associated Dysregulation of Inter-Organ Metabolic Cycles between the Liver and Skeletal Muscle 著者 Riku Egami, Toshiya Kokaji, Atsushi Hatano, Katsuyuki Yugi, Miki Eto, Keigo Morita, Satoshi Ohno, Masashi Fujii, Ken-ichi Hironaka, Saori Uematsu, Akira Terakawa, Yunfan Bai, Yifei Pan, Takaho Tsuchiya, Haruka Ozaki, Hiroshi Inoue, Shinsuke Uda, Hiroyuki Kubota, Yutaka Suzuki, Masaki Matsumoto, Keiichi I. Nakayama, Akiyoshi Hirayama, Tomoyoshi Soga, and Shinya Kuroda* DOI番号 論文URL https://www.cell.com/iscience/fulltext/S2589-0042(21)00185-1
用語解説
注1 トランスオミクスネットワーク
シグナル経路や転写産物発現、タンパク質発現、代謝階層にまたがる 大規模な代謝制御ネットワーク ↑
注2 臓器連関代謝サイクル
肝臓や筋肉といった代謝臓器間の、血液を介した代謝物のやりとり ↑
注3 トランスクリプトーム解析
網羅的な遺伝子発現計測 ↑
注4 プロテオーム解析
網羅的なタンパク質発現計測 ↑
注5 メタボローム解析
網羅的な極性低分子化合物量の計測 ↑
注6 リピドーム解析
網羅的な脂質化合物の計測 ↑


