DATE2021.08.06 #プレスリリース
メラトニン受容体のシグナル伝達複合体の構造を解明
〜 睡眠や概日リズムの構造基盤の理解と睡眠薬の開発に貢献 〜
岡本 紘幸(生物科学専攻 博士課程1年)
井上 飛鳥(東北大学 准教授)
西澤 知宏(生物科学専攻 准教授(研究当時)/横浜市立大学 教授(現所属)
濡木 理(生物科学専攻 教授)
寿野 良二(関西医科大学 講師)
清水(小林)拓也(関西医科大学 教授)
野村 紀通(京都大学 准教授)
岩田 想(京都大学 教授)
発表のポイント
- 睡眠薬ラメルテオンとGiタンパク質三量体(注1)が結合したメラトニン受容体(注2) MT1のシグナル伝達複合体(注3) の立体構造を解明することに成功しました。
- 受容体の活性化に重要なラメルテオンとの相互作用を特定しました。さらに、他のシグナル伝達複合体との構造比較から、Gタンパク質の共役選択性を特徴づける受容体の細胞内側の空間的な特徴を見出しました。
- 本研究は、メラトニン受容体を標的とする創薬開発に貢献するとともに、GPCR(注4)のシグナル伝達の初発段階であるGタンパク質共役選択性の理解につながります。
発表概要
睡眠は我々の生命維持に必須であり、ホルモンなど多様な情報伝達物質で制御されます。本研究で着目したメラトニン(注5) は特に睡眠の誘導で中心的な役割を果たし、その過程ではGPCRの一種であるメラトニン受容体とGiタンパク質三量体による神経細胞の活動を抑制するシグナルが重要となります。メラトニン受容体は睡眠障害に対する治療標的として注目され、2010年に不眠症治療薬ラメルテオン(商品名ロゼレム)が承認されています。そのため、メラトニン受容体を含むシグナル伝達複合体の構造決定は睡眠のメカニズムの原子レベルでの理解のみならず、より効果的な薬の開発に貢献します。近年メラトニン受容体の結晶構造が報告されましたが、これらは不活性型構造を示しており、メラトニン受容体の活性化に伴う構造変化やシグナル伝達因子であるGiタンパク質三量体と選択的に共役する機構は不明なままでした。
今回、東京大学大学院理学系研究科の濡木理 教授らのグループは、クライオ電子顕微鏡による単粒子解析法(注6) でメラトニン受容体MT1とGiタンパク質三量体で構成されるシグナル伝達複合体の立体構造を解明しました。さらに国内外の複数の研究室との共同研究の下で機能解析やバイオインフォマティクス解析を行い、受容体の活性化メカニズムやGiタンパク質三量体と選択的に結合する機構を明らかにしました。この研究成果により、睡眠障害の治療薬開発が促進されると共に、GPCRとGタンパク質との選択的なシグナル伝達に関する研究が進展することが期待されます。
本研究の成果は、英国夏時間8月5日(午後4時)に科学雑誌Nature Structural and Molecular Biology誌に掲載されました。
発表内容
研究の背景・先行研究における問題点
メラトニンは夜間に分泌され、睡眠の誘導や概日リズム(注7)の制御に関与するホルモンです。分泌されたメラトニンは、膜受容体タンパク質であるGPCRの一種のメラトニン受容体に結合し、メラトニン受容体がGiタンパク質三量体を介して細胞内に抑制性シグナルを伝達することで、最終的に睡眠の誘導などの生理作用をもたらします。これらの生理作用の重要性から、メラトニンおよびメラトニン受容体は、睡眠障害などの治療標的として注目を集めており、多くの作動薬(注8)が開発され、臨床に用いられていますが、これらの薬剤がどのようにしてメラトニン受容体に作用してシグナルを伝えるのかに関してはあまり分かっていませんでした。
近年、X線結晶構造解析によって、睡眠障害の治療薬が結合した状態でメラトニン受容体の立体構造が報告され、薬剤の認識機構などが解明されました。しかし一連の構造解析では、受容体の安定化のために様々な変異が導入された、生理活性を示さないような変異体が用いられていました。そのため、受容体を活性化状態にする作動薬が結合しているにも関わらず不活性化型の構造を示しており、生理的な状況を反映していない状態でした。以上から、メラトニン受容体がリガンドによって活性化するメカニズムは不明なままであり、治療薬の開発に求められる詳細な作動メカニズムは解明されていない状況にありました。
研究内容(具体的な手法など詳細)
今回、東京大学大学院理学系研究科の岡本紘幸 大学院生、西澤知宏 准教授(研究当時)、濡木理 教授らの研究グループは、クライオ電子顕微鏡による単粒子解析法を用いて、リガンドが結合し活性化したメラトニン受容体MT1およびGiタンパク質三量体で構成されるシグナル伝達複合体の立体構造を解明しました(図1)。
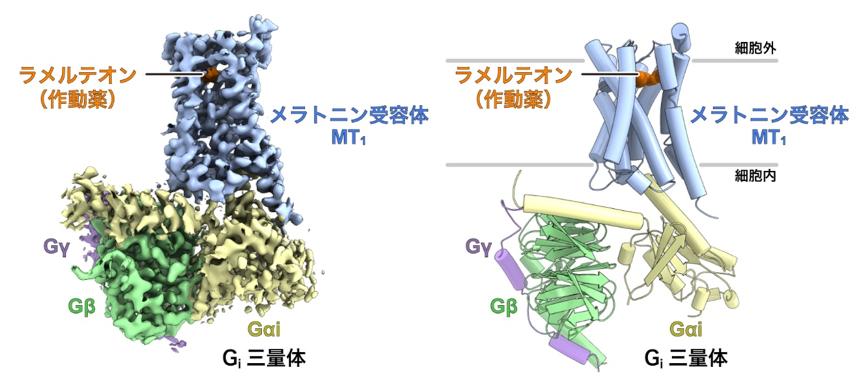
図1:メラトニン受容体MT1-Giシグナル伝達複合体の全体構造
左:メラトニン受容体MT1-Giシグナル伝達複合体の密度マップ。
右:密度マップに基づいて構築したメラトニン受容体MT1-Giシグナル伝達複合体の立体構造モデル。
これにより、メラトニン受容体が活性化するメカニズムを明らかにしました。さらに、東北大学の井上飛鳥 准教授の開発したGiタンパク質三量体の活性化検出法を用いたメラトニン受容体の変異体解析により、先行研究では明らかとなっていなかった受容体の活性化に重要なアミノ酸残基を新しく特定することに成功しました(図2)。
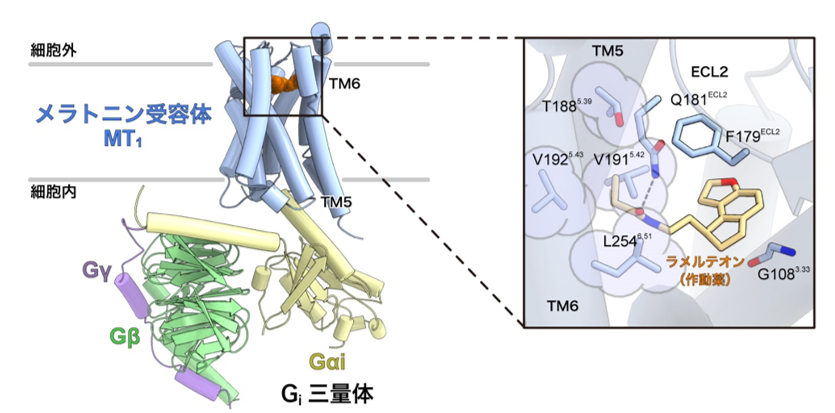
図2:活性化状態のメラトニン受容体MT1による作動薬ラメルテオンと認識機構
左:メラトニン受容体MT1-Giシグナル伝達複合体の全体構造。
右:リガンド結合部位の拡大図。薄紫色で囲ったアミノ酸残基(T188、V191、V192、L254)がメラトニン受容体の活性化に重要であることを今回初めて発見した。これらのアミノ酸残基は第5、第6膜貫通ヘリックス(TM5・TM6)に存在し、多くのGPCRの間で保存されている「活性化モチーフ」と呼ばれるアミノ酸残基群の近くに位置していた。
GPCRによって活性化されるGタンパク質にはいくつかの種類があり、MT1はGiと呼ばれるGタンパク質を選択的に活性化することが知られています。GPCRは一般的に活性化に際して6番目の膜貫通ヘリックス(TM6)が構造変化することが知られていますが、MT1受容体では他のGiシグナル伝達受容体(注4)に比べてTM6が大きく跳ね上がるように動くことを見出しました(図3)。これまでの研究から、Giシグナル伝達受容体ではGsシグナル伝達受容体(注4)に比べて、このTM6の構造変化が小さく、この違いが共役するGタンパク質の選択性を決めていると考えられてきました。一方、今回明らかにしたMT1受容体では、Gsシグナル伝達受容体と同程度の大きさでTM6の構造変化が見られました。したがって、このTM6の動き自体はGタンパク質シグナルの選択性とは直接的には関係がなく、TM6の構造変化の程度はむしろTM6の疎水性アミノ酸の分布に大きく依存することが示唆されました。
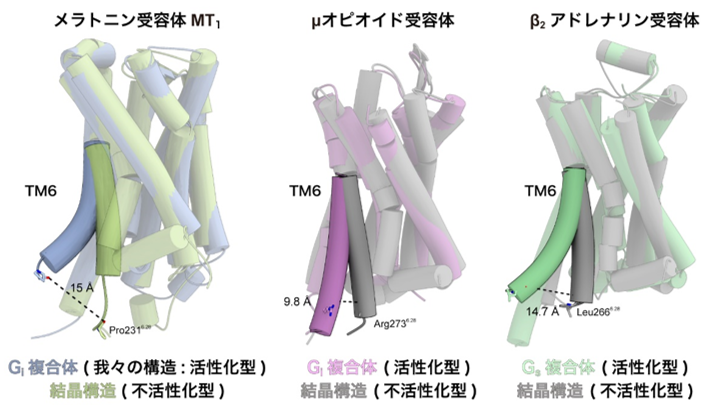
図3:不活性化型の結晶構造とシグナル伝達複合体の構造を比較
メラトニン受容体MT1(左)、μオピオイド受容体(中央)、β2アドレナリン受容体(右)のそれぞれのTM6について、不活性化型の構造を取っている結晶構造と、活性化状態の構造を示すシグナル伝達複合体の構造を比較した。メラトニン受容体MT1の第6膜貫通ヘリックス(TM6)は、他のGiシグナル伝達受容体に比べて大きく構造変化し、Gsシグナル伝達受容体と同程度まで跳ね上がりを示していた。
一方で、GPCRの構造を網羅的に比較したところ、Giシグナル伝達受容体では、細胞内側の空間がGsシグナル伝達受容体に比べて狭いという特徴がわかりました(図4)。さらにGsシグナル伝達受容体に比べて、Giシグナル伝達受容体では細胞内ループなどを介した相互作用が弱く、GiのC末端のみで相互作用していることが明らかになりました。イタリアScuola Normale Superiore di PisaのRaimondi准教授による構造情報を用いたバイオインフォマティクス解析の結果から、Gsシグナル伝達受容体間ではGタンパク質と受容体の相互作用が保存されている一方で、Giシグナル伝達受容体ではばらつきが大きく、受容体ごとにやや柔軟な相互作用を形成していることが明らかになりました。以上からGi共役とGs共役の選択性はTM6の構造変化の程度の違いだけで決まるというこれまでの考えに対し、受容体の細胞内側の空間的な特徴や、細胞内ループを介したGタンパク質との相互作用など、より多くの要素が複合的に選択性に寄与することが明らかになりました。
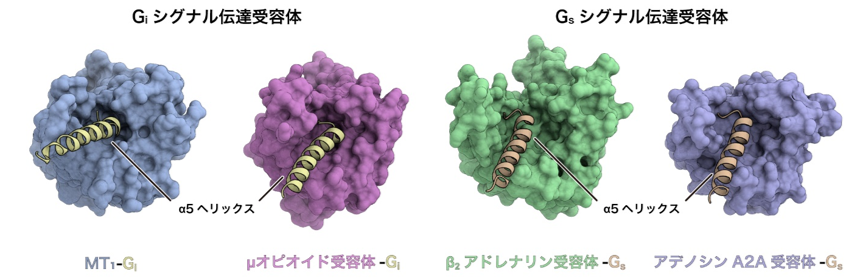
図4:Giシグナル伝達受容体とGsシグナル伝達受容体の構造を比較
Giシグナル伝達受容体(左:メラトニン受容体MT1、右:μオピオイド受容体)とGsシグナル伝達受容体(左:β2アドレナリン受容体、右:アデノシンA2A受容体)のそれぞれについて、細胞内側から見た構造を比較した。Giシグナル伝達受容体は細胞内側の空間が狭い一方で、Gsシグナル伝達受容体では細胞内側の空間が比較的広いことが分かる。
社会的意義・今後の予定
本研究における活性化型のメラトニン受容体の立体構造と、先行研究のX線結晶構造解析による不活性型の立体構造とを組み合わせることで、計算機シミュレーションによるメラトニン受容体の薬剤探索が加速することで、不眠症や、時差ボケなど概日リズムの乱れによる体調不良に対する治療薬の開発へとつながることが期待されます。
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(研究代表者:濡木理)および若手研究(A)「Gタンパク質共役型受容体のリガンド多様性に関する構造的基盤の研究」(研究代表者:西澤知宏)の一環で行われました。また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」の一環として、クライオ電子顕微鏡などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援および「革新的先端研究開発支援事業」ソロタイプ(PRIME)の支援により行われました。
発表雑誌
-
雑誌名 Nature Structural and Molecular Biology 論文タイトル Cryo-EM structure of the human MT1-Gi signaling complex 著者 Hiroyuki H. Okamoto, Hirotake Miyauchi, Asuka Inoue*, Francesco Raimondi, Hirokazu Tsujimoto, Tsukasa Kusakizako, Wataru Shihoya, Keitaro Yamashita, Ryoji Suno, Norimichi Nomura, Takuya Kobayashi, So Iwata, Tomohiro Nishizawa*, Osamu Nureki* (*:共同責任著者) DOI番号 10.1038/s41594-021-00634-1
論文URL
用語解説
注1 Giタンパク質三量体、Gタンパク質三量体
Gタンパク質は、細胞内情報伝達に関わるGTP結合タンパク質であり、Gα、Gβ、Gγサブユニットの三量体によって構成され、活性化されたGPCR(注5)によって活性化されます。活性化されたGタンパク質三量体ではGDP-GTP交換反応が起き、GαとGβ-Gγの二つに解離します。解離したサブユニットが下流のシグナル伝達因子と結合し活性化することで、細胞に様々なシグナル応答が生じます。Gαサブユニットは大きくGs、Gi、Gq/11、G12/13の4種類に分別され、特にGiタンパク質三量体は、下流でアデニル酸シクラーゼの活性を阻害することで、抑制性のシグナルを伝達します。 ↑
注2 メラトニン受容体
メラトニン受容体は、低分子リガンドを結合して従来からの主な創薬標的であるクラス A GPCRに分類され、メラトニンと結合することで活性化状態となり、アデニル酸シクラーゼを不活性化する抑制性Gタンパク質三量体(Giタンパク質三量体)を選択的に活性化します。メラトニン受容体にはMT1とMT2の2つのサブタイプが存在し、主に脳の視交叉上核に発現するMT1が、特に睡眠の誘導で重要な役割を果たすことが知られています。 ↑
注3 シグナル伝達複合体
活性化したGPCRはGタンパク質三量体と結合することでシグナル伝達複合体を形成し、Gタンパク質三量体でのGDP-GTP交換反応が起きやすい立体構造に安定化されます。クライオ電子顕微鏡による単粒子解析法の発達によって、これまでに多くのGPCRシグナル伝達複合体の立体構造が報告されてきました。 ↑
注4 GPCR(Gタンパク質共役受容体)、Giシグナル伝達受容体、Gsシグナル伝達受容体
7本のαヘリックスで構成される膜タンパク質で、膜受容体タンパク質のなかで最大のファミリーを形成しています。N末端が細胞外、C末端が細胞内に存在し、細胞外領域で特定のリガンドが結合することで活性化し、細胞内のGタンパク質三量体を活性化することでシグナルを伝達します。体内で多様な生理作用の調節に重要な役割を果たすことから、既承認薬の30%以上がGPCRを標的にした薬剤になっています。これらのなかで、Giタンパク質三量体と共役するものをGiシグナル伝達受容体、Gsタンパク質三量体と共役するものをGsシグナル伝達受容体と呼びます。 ↑
注5 メラトニン
メラトニンは、トリプトファンを出発物質にセロトニンを経て、脳の松果体で合成されるホルモンです。メラトニンは1958年にLernerらが発見し、これまでの研究から、夜間に多く合成されて睡眠の誘導や概日リズムの調節に関与することが明らかになっています。こうした重要な生理現象に関与することから、メラトニンおよびメラトニン受容体(注2)は睡眠障害などの治療標的として注目されており、これまでメラトニンに類似した化合物が睡眠障害の治療薬として開発されてきました。 ↑
注6 クライオ電子顕微鏡による単粒子解析法
クライオ(超低温)電子顕微鏡を用いてタンパク質などの生体高分子試料を撮影し、多数の撮影画像を画像処理することで立体構造を再構成して、タンパク質などの生体高分子の立体構造を決定する手法です。液体窒素(-196℃)による冷却下でタンパク質などの生体高分子試料に対して電子線を照射し、試料の観察および撮影を行います。検出器などにおける目覚ましい技術革新によってタンパク質などの生体高分子の立体構造を高分解能で決定する手法として普及し、2017年には開発に貢献した海外の研究者三名にノーベル化学賞が贈られました。↑
注7 概日リズム
約25時間の周期で変動する生理現象であり、動物、植物、菌類、藻類などほとんどの生物で保存されています。概日リズムは、光などの環境の周期変動が無い状態でも起こる現象で、睡眠・覚醒を含む多くの生命現象に関与しており、生体内で重要な役割を担っています。↑
注8 作動薬
作動薬は、受容体タンパク質のリガンドとして作用し、結合によって受容体の活性を向上させる薬剤です。特にメラトニン受容体では、生理的なホルモンであるメラトニンも作動薬として作用し、メラトニン受容体を標的とする睡眠障害の治療薬の多くが作動薬となっています。↑


